题目内容
A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.A原子的最外层电子比B原子的最外层电子少2个,B原子的质子数是其电子层数的4倍.A、B、C三种元素能结合成化合物C2AB3,在1mol C2AB3中共有52mol电子.D元素的单质0.5mol与酸全部反应生时,有9.03×1023个电子转移.E元素的单质是一种黄绿色气体,水溶液具有漂白性.试填写下列空白:
(1)写出元素A和E的名称:A ,E .
(2)元素B在周期表中的位置为第二周期 族.
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为含有 键(填“极性”或“非极性”)的 化合物(填“离子”或“共价”),写出该化合物的电子式 .
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式 .
(1)写出元素A和E的名称:A
(2)元素B在周期表中的位置为第二周期
(3)由元素B、C形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为含有
(4)写出C、D两种元素对应的最高价氧化物的水化物相互反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.B原子的质子数是其电子层数的4倍,B为O或Mg,而A原子的最外层电子比B原子的最外层电子少2个,故B只能为O,则A为碳;A、B、C三种元素能结合成化合物C2AB3,在1mol C2AB3中共有52mol电子,则C元素原子电子数=(52-6-24)÷2=11,则C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个即1.5mol电子转移,所以D元素的化合价为+3价,即D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,据此解答.
解答:
解:A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.B原子的质子数是其电子层数的4倍,B为O或Mg,而A原子的最外层电子比B原子的最外层电子少2个,故B只能为O,则A为碳;A、B、C三种元素能结合成化合物C2AB3,在1mol C2AB3中共有52mol电子,则C元素原子电子数=(52-6-24)÷2=11,则C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个即1.5mol电子转移,所以D元素的化合价为+3价,即D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,
(1)由上述分析可知,A为碳,E为氯,故答案为:碳;氯;
(2)B为氧元素,在周期表中的位置为第二周期ⅥA族,故答案为:ⅥA;
(3)由元素O、Na形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为Na2O2,过氧根离子中氧原子之间形成非极性键,属于离子化合物,其电子式为 ,故答案为:非极性;离子;
,故答案为:非极性;离子; ;
;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
(1)由上述分析可知,A为碳,E为氯,故答案为:碳;氯;
(2)B为氧元素,在周期表中的位置为第二周期ⅥA族,故答案为:ⅥA;
(3)由元素O、Na形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为Na2O2,过氧根离子中氧原子之间形成非极性键,属于离子化合物,其电子式为
 ,故答案为:非极性;离子;
,故答案为:非极性;离子; ;
;(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,难度不大,注意对基础知识的全面掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有质量分数为a的氨水溶液,加入等质量的水稀释后,浓度从C1 mol?L-1成为C2mol?L-1,下列说法正确的是( )
| A、C1=2C2 |
| B、C1>2C2 |
| C、C1<2C2 |
| D、C1=a |
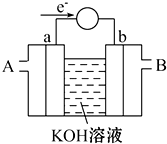
 如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )
如图是氢氧燃料电池构造示意图,电解质用的是30%的KOH溶液.关于该电池的说法不正确的是( )| A、a极是负极 |
| B、电子由b通过灯泡流向a |
| C、氢氧燃料电池是环保电池 |
| D、正极的电极反应是:O2+2H2O+4e-=4OH- |
对可逆反应2A(s)+3B(g)?C(g)+2D(g);△H<0,在一定条件下达到平衡,下列叙述正确的是( )
| A、增加A的量,平衡向正反应方向移动 |
| B、升高温度,平衡向逆反应方向移动,v(正)增大 |
| C、压强增大一倍,平衡不移动,v(正)、v(逆)增大 |
| D、加入催化剂,B的转化率提高 |
 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
 (1)已知2Cu(s)+
(1)已知2Cu(s)+