题目内容
1.下列互为同分异构体的是( )| A. | 葡萄糖和果糖 | B. | 氧气和臭氧 | C. | 正丁烷和正戊烷 | D. | 金刚石和石墨 |
分析 根据同分异构体是指分子式相同,但结构不同的化合物,据此解答.
解答 解:A.果糖、葡萄糖分子式相同,结构不同,互为同分异构体,故A正确;
B.氧气和臭氧是由氧元素组成的性质不同的单质,互称同素异形体,故B错误;
C.正丁烷和正戊烷分子式不同,不属于同分异构体,故C错误;
D.金刚石和石墨由碳元素组成的性质不同的单质,互称同素异形体,故D错误;
故选A.
点评 本题考查了有机化合物的同分异构体的判断和理解,掌握概念实质是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.为了探究外界条件对过氧化氢分解速率的影响.某化学兴趣小组做了以下实验:
回答下列问题:
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验a的目的是探究温度对H2O2分解速率的影响,FeCl3在实验中的作用是催化作用(或催化剂),该实验得出的结论是温度越高,H2O2分解速率越快.
(3)实验b的目的是探究浓度对H2O2分解速率的影响,但未观察到预期的实验现象.为了达到实验目的,请用现有实验中提供的试剂或条件,提出对实验b的改进意见分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中).
| 实验编号 | 实验操作 | 实验现象 |
| a | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol•L-1 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中无明显气泡产生 试管B中出现大量气泡 |
| b | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 两支试管中都未见明显气泡 |
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验a的目的是探究温度对H2O2分解速率的影响,FeCl3在实验中的作用是催化作用(或催化剂),该实验得出的结论是温度越高,H2O2分解速率越快.
(3)实验b的目的是探究浓度对H2O2分解速率的影响,但未观察到预期的实验现象.为了达到实验目的,请用现有实验中提供的试剂或条件,提出对实验b的改进意见分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中).
12.一定条件下,有关金属腐蚀的下列说法不正确的是( )
| A. | 在酸性较强的溶液中,金属主要发生析氢腐蚀 | |
| B. | 钢铁制品吸氧腐蚀时正极反应:O2+2H2O+4e-═4OH- | |
| C. | 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接 | |
| D. | 在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀 |
9.短周期元素A和B可形成AB2型化合物,若B原子序数为m,则A的原子序数为下面算式中的( )
①m+6
②m+8
③m-2
④m-1
⑤m+4
⑥m+14.
①m+6
②m+8
③m-2
④m-1
⑤m+4
⑥m+14.
| A. | ②③⑥ | B. | ①②③④ | C. | ①②⑥ | D. | ①②③④⑤⑥ |
16.NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质.写出化学反应方程式:NaClO+CO2+H2O=NaHCO3+HClO.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分,从而判断该消毒液是否变质.

限选试剂:98%浓硫酸、1%品红溶液、1.0mol•L-1 KI淀粉溶液、1.0mol•L-1 NaOH溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案.
(3)测定消毒液中NaClO的浓度.实验步骤如下:
①量取25.00mL消毒液放入锥形瓶中,加入过量的a mol•L-1 Na2SO3溶液b mL.
②定量分析.使c mol•L-1的酸性KMnO4溶液和剩余的Na2SO3发生反应.重复实验3次,测得平均消耗酸性KMnO4溶液V mL;此过程中涉及的反应有:NaClO+Na2SO3═NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4═K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为$\frac{(2ab-5vc)}{50}$mol•L-1(用含a、b、c、V的代数式表示).
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质.写出化学反应方程式:NaClO+CO2+H2O=NaHCO3+HClO.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分,从而判断该消毒液是否变质.

限选试剂:98%浓硫酸、1%品红溶液、1.0mol•L-1 KI淀粉溶液、1.0mol•L-1 NaOH溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案.
| 所加试剂 | 预期现象和结论 |
| 向试管A中加足量①1.0 mol/L KI淀粉溶液;试管B中加1%品红溶液;试管C中加②澄清石灰水. | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质;③若A中溶液变蓝色,B中溶液不退色(无变化),C中溶液不变浑浊(无变化),则消毒液未变质,则消毒液未变质; ④若A中溶液不变蓝色(无变化),B中溶液不退色(无变化),C中溶液变浑浊则消毒液完变质,则消毒液完全变质. |
①量取25.00mL消毒液放入锥形瓶中,加入过量的a mol•L-1 Na2SO3溶液b mL.
②定量分析.使c mol•L-1的酸性KMnO4溶液和剩余的Na2SO3发生反应.重复实验3次,测得平均消耗酸性KMnO4溶液V mL;此过程中涉及的反应有:NaClO+Na2SO3═NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4═K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为$\frac{(2ab-5vc)}{50}$mol•L-1(用含a、b、c、V的代数式表示).
6.写出下列反应的化学方程式并注明反应类型
| 写出化学方程式 | 写出反应类型 |
| (1)乙烯通入溴水:CH2=CH2+Br2→CH2Br-CH2Br | 加成反应 |
| (2)甲烷与氯气在光照下反应(写第一步):CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | 取代反应 |
(3)苯与浓硝酸在50~60℃及浓硫酸催化下反应: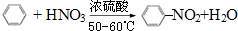 | 取代反应 |
10. 在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
 在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A. | 1100℃时该反应平衡常数为 1.64 | B. | 压强:p4>p3>p2>p1 | ||
| C. | 上述反应的△H<0 | D. | 压强为 p4时,在y点:v 正>v 逆 |
 “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示: .
.