题目内容
9.短周期元素A和B可形成AB2型化合物,若B原子序数为m,则A的原子序数为下面算式中的( )①m+6
②m+8
③m-2
④m-1
⑤m+4
⑥m+14.
| A. | ②③⑥ | B. | ①②③④ | C. | ①②⑥ | D. | ①②③④⑤⑥ |
分析 两种元素可以组成AB2型化合物,如果A元素化合价为+4、B元素化合价为-2,则A元素位于第IVA族、B元素位于第VIA族,也可能为SO2,都位于第VIA族,如为NO2,则A位于ⅤA族,如果A元素化合价为+2价、B元素化合价为-1价,则A位于第IIA、B位于第VIIA族,以此解答该题,
解答 解:两种元素可以组成AB2型化合物,如果A元素化合价为+4、B元素化合价为-2,则A元素位于第IVA族、B元素位于第VIA族,可为CO2、SiO2或CS2,若B原子序数为m,则A的原子序数分别为m-2、m+6、m-10;
也可能为SO2,都位于第VIA族,若B原子序数为m,则A的原子序数为m+8;
如为NO2,则A位于ⅤA族,若B原子序数为m,则A的原子序数为m-1,
如果A元素化合价为+2价、B元素化合价为-1价,则A位于第IIA、B位于第VIIA族,可为MgF2、MgCl2等,若B原子序数为m,则A的原子序数分别为m+3、m-5,
题中①②③④都正确.
故选B.
点评 本题考查周期表的结构及应用,涉及短周期元素形成常见化合物的化学式,根据可能的化合价来判断元素所在的周期表中的位置,要求学生要有坚实的基础知识,题目难度中等.

练习册系列答案
 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
19.关于下列装置说法正确的是( )
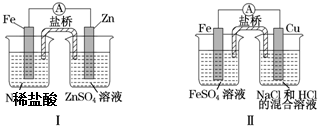

| A. | 装置Ⅰ中铁溶解、锌不溶解,装置Ⅱ中铁溶解、铜不溶解 | |
| B. | 装置Ⅰ中电流表指针不偏转,装置Ⅱ中电流表指针偏转 | |
| C. | 装置Ⅰ和装置Ⅱ中正极反应均是2H++2e-═2H2 | |
| D. | 盐桥中的阳离子均向右侧烧杯移动 |
20.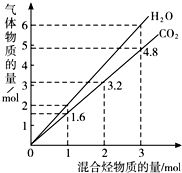 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔.
 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔.
| A. | ②⑤⑥ | B. | ②⑥ | C. | ②④ | D. | ②③ |
4.实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法错误的是( )
| A. | NaNO2是氧化剂 | |
| B. | 氧化剂与还原剂物质的量之比为1:1 | |
| C. | NH4Cl中的氮元素被氧化 | |
| D. | 每生成1 mol N2转移的电子的物质的量为6 mol |
1.下列互为同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 氧气和臭氧 | C. | 正丁烷和正戊烷 | D. | 金刚石和石墨 |
18.下列各组物质中属于同分异构体的是( )
| A. |  和 和 | B. | CH3CH2OH和CH3 CH2-O-CH2CH3 | ||
| C. |  和 和 | D. |  和 和 |
1.烃C6H14的各种同分异构体中,所含甲基数和它的一氯代物的数目之间的关系如下所述,其中正确的是( )
| A. | 2个甲基,能生成4种一氯代物 | B. | 3个甲基,能生成3种一氯代物 | ||
| C. | 3个甲基,能生成5种一氯代物 | D. | 4个甲基,能生成5种一氯代物 |

 ;该有机物的一氯代物有1种,该有机物的二氯代物有2种.
;该有机物的一氯代物有1种,该有机物的二氯代物有2种.