题目内容
11.设NA为阿伏加德罗常数,下列说法中正确的是( )| A. | 在常温常压下,11.2LN2所含有的原子数目为NA | |
| B. | 活泼金属从盐酸中置换出1molH2,电子转移的数目为NA | |
| C. | 500mL0.5 mol/L的硫酸铝溶液中,硫酸根离子的浓度为1.5 mol/L | |
| D. | 1.7克氨气所含有的电子数目为10 NA |
分析 A、常温常压时,气体摩尔体积大于22.4L/mol;
B、活泼金属从盐酸中置换出1mol氢气时,氢元素的价态由+1价变为0价;
C、硫酸铝的化学式为Al2(SO4)3,硫酸根的浓度是硫酸铝浓度的3倍;
D、求出氨气的物质的量,然后根据氨气中含10个电子来分析.
解答 解:A、常温常压时,气体摩尔体积大于22.4L/mol,故11.2L氮气的物质的量小于0.5mol,故含有的原子个数小于NA个,故A错误;
B、活泼金属从盐酸中置换出1mol氢气时,氢元素的价态由+1价变为0价,故当生成1mol氢气时,转移2NA个电子,故B错误;
C、硫酸铝的化学式为Al2(SO4)3,硫酸根的浓度是硫酸铝浓度的3倍,则硫酸根离子的浓度为1.5mol/L,故C正确;
D、1.7g氨气的物质的量为0.1mol,而氨气中含10个电子,故0.1mol氨气中含NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
7.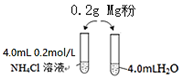 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是因为气温低于25℃时,Kw小于1.0×10-14,纯水的pH略大于7
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气)
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:NH4++H2O?NH3•H2O+H+
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
①上述探究实验1-2选用的盐酸为D(填字母).
A、1mol•L-1 B、pH=1.0 C、0.2mol•L-1 D、pH=5.90
②通过实验对比,说明NH4Cl水解产生的H+对反应影响小于NH4+对反应影响(填“小于”、“大于”或“等于”).
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素.
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂.
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式Mg+2 NH4+=Mg2++2NH3↑+H2↑.
 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是因为气温低于25℃时,Kw小于1.0×10-14,纯水的pH略大于7
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气)
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:NH4++H2O?NH3•H2O+H+
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
| 序号 | 实验试剂 | 实验现象 | |
| 实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
| 实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
A、1mol•L-1 B、pH=1.0 C、0.2mol•L-1 D、pH=5.90
②通过实验对比,说明NH4Cl水解产生的H+对反应影响小于NH4+对反应影响(填“小于”、“大于”或“等于”).
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素.
| 实验序号 | 实验试剂 | |
| 实验2-1 | 0.20g镁粉 | 3.0 mL 0.2mol/LNaCl溶液 |
| 实验2-2 | 0.20g镁粉 | 3.0 mL0.2mol/LNaNO3溶液 |
| 实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
| 实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式Mg+2 NH4+=Mg2++2NH3↑+H2↑.
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 2.24 L CO2中含有的原子数为0.3NA | |
| C. | 相同质量的N2O4与NO2中所含原子数目不相同 | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
3.某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定.
测定中和热的实验装置如图所示.
(1)大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失,从实验装置上看,图中缺少的一种玻璃仪器环形玻璃搅拌棒
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表
①请填写表中的空白:
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).(已知:Q=m•c•△t)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),所求中和热相等(填“相等”、“不相等”);,若用50mL0.50mol•L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会偏小(填“偏大”、“偏小”、“不受影响”).
测定中和热的实验装置如图所示.
(1)大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失,从实验装置上看,图中缺少的一种玻璃仪器环形玻璃搅拌棒
(2)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表
①请填写表中的空白:
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | 温度差平均值℃ | ||
| H2SO4 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | 6.1 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | 3.9 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | 4.1 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)ac.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(4)实验中若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),所求中和热相等(填“相等”、“不相等”);,若用50mL0.50mol•L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会偏小(填“偏大”、“偏小”、“不受影响”).
1.分子式为C5H11Cl的有机物的同分异构体有( )
| A. | 5 | B. | 8 | C. | 9 | D. | 10 |
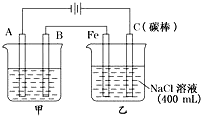 如图为相互串联的甲乙两电解池,试回答:
如图为相互串联的甲乙两电解池,试回答: