题目内容
某电镀厂有两种废水需要处理,一种废水中含上述B、C元素的BC-离子(B为C元素,C为N元素),另一种废水中含有Cr2O72-离子.该厂拟定下图所示的废水处理流程.

回答下列问题:
(1)上述处理废水的流程中主要使用的方法是 .
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因 .
(3)②中反应后无气体放出,该反应的离子方程式为 .
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol e-,该反应的离子方程式为 .

回答下列问题:
(1)上述处理废水的流程中主要使用的方法是
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因
(3)②中反应后无气体放出,该反应的离子方程式为
(4)③中反应时,每0.4mol Cr2O72-转移2.4mol e-,该反应的离子方程式为
考点:"三废"处理与环境保护
专题:化学应用
分析:(1)由转化图及图中的物质可知,NaClO、Cr2O72-离子都具有氧化性,则实现离子的转化是利用氧化还原反应实现的;
(2)利用盐的水解来分析盐溶液显碱性的原因;
(3)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(2)利用盐的水解来分析盐溶液显碱性的原因;
(3)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(4)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
解答:
解:含有CN-离子的废水中加入次氯酸钠溶液会发生氧化还原反应:CN-+ClO-═CNO-+Cl-,得到含有CNO-、Cl-的溶液,含有Cr2O72-的废水中加入还原剂硫代硫酸钠,会发生氧化还原反应:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,继续处理得到待检水样.
(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法,故答案为:氧化还原法;
(2)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为ClO-+H2O HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-;
(3)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,故答案为:CN-+ClO-═CNO-+Cl-;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法,故答案为:氧化还原法;
(2)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为ClO-+H2O
 HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-; (3)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,故答案为:CN-+ClO-═CNO-+Cl-;
(4)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
点评:本题考查利用氧化还原反应来实现废水的转化,注重了化学与实际生产的联系,学生应学会利用物质的性质、元素的化合价、电子守恒等来解答.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、4 4 g CO2气体中所含原子数为2 NA |
| B、常温常压下,22.4 L氢气所含原子数为2 NA |
| C、1 L mo l?L-1的硫酸钠溶液中钠离子数为2 NA |
| D、在Cl2参与的反应中,1 mol Cl2得到的电子数一定是2NA |
关于键长、键能和键角,下列说法不正确的是( )
| A、键角的大小与键长、键能的大小无关 |
| B、键长的大小与成键原子的半径和成键数目有关 |
| C、键角是描述分子立体结构的重要参数 |
| D、键能越大,键长越长,共价化合物越稳定 |
下列叙述中,不正确的是( )
| A、CaCO3属于碳酸盐 |
| B、盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| C、蓝矾(CuSO4?5H2O)和干冰属于化合物,铁矿石属于混合物 |
| D、通过化学反应,可由Ba(OH)2一步转化生成NaOH |
用10mL 2mol?Lˉ1的硫酸与铁片反应制备氢气,下列措施中,你认为能加快化学反应速率的是( )
| A、增加铁片的用量 |
| B、将2 mol?Lˉ1的硫酸改为98%的硫酸 |
| C、再加入10 mL 2 mol?Lˉ1的硫酸 |
| D、将铁片粉碎 |
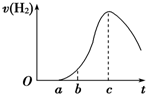 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题: