题目内容
7.在相同温度时,100mL 0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )| A. | 溶液的pH | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的量 | D. | 溶液中的c(CH3COOH) |
分析 醋酸为弱电解质,醋酸的浓度越大,则电离程度越小,但是溶液中氢离子浓度越大;中和时消耗的强氧化钠的物质的量取决于醋酸的物质的量,据此进行判断.
解答 解:A.酸的浓度越大,c(H+)越大,pH越小,前者氢离子浓度小,所以pH前者大于后者,故A正确;
B.醋酸的电离常数只与温度有关,温度相同,电离常数相同,故B错误;
C.计算两溶液中醋酸的物质的量,n(前)=c1•V1=0.1 L×0.01 mol•L-1=1×10-3 mol,n(后)=c2•V2=0.01 L×0.1 mol•L-1=1×10-3 mol,两者相等,因而中和时消耗的NaOH的量相等,故C错误;
D.由n=cV可知,100mL 0.01mol/L的醋酸溶液中溶质的物质的量为0.001mol,10mL0.1mol/L的醋酸溶液中溶质的物质的量为0.001mol,但前者浓度小,电离程度大,前者的CH3COOH的物质的量小,故D错误;
故选A.
点评 本题考查弱电解质的电离平衡及其影响,题目难度不大,注意把握弱电解质的电离特点,明确醋酸浓度越大、电离程度越小是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列事实不能证明CH3COOH是弱电解质的是( )
| A. | 在CH3COONa溶液中通入SO2,生成CH3COOH | |
| B. | 等浓度的盐酸、CH3COOH溶液分别和锌反应,开始时盐酸的反应速率快 | |
| C. | 常温下0.1 mol•L-1 CH3COOH溶液的pH=2.1 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗 |
15.下列图示与对应的叙述相符的是( )

| A. | 图I表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ.mol-1 | |
| B. | 图Ⅱ表示某可逆反应正、逆反应速率随温度的变化,则该反应的正反应是放热反应 | |
| C. | 图Ⅲ表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
19. 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)配制待测液,用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯、量筒和胶头滴管外,还需要的玻璃仪器有1000ml容量瓶、玻璃棒.
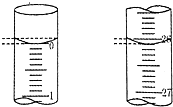
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,达到滴定终点的判断依据是:滴入最后一滴盐酸时,溶液由红色变为无色,并且半分钟之内不恢复红色,若滴定开始和结束时,酸式滴定管中的液面如图所示,则终点读数26.10mL.
(3)数据处理,某学生根据三次实验分别记录有关数据如下:
则该氢氧化钠溶液的物质的量浓度c(NaOH)=0.1044mol/L.(保留三位有效数字)
(4)若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将偏低.(选填“偏高”、“偏低”或“无影响”)
 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)配制待测液,用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯、量筒和胶头滴管外,还需要的玻璃仪器有1000ml容量瓶、玻璃棒.
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,达到滴定终点的判断依据是:滴入最后一滴盐酸时,溶液由红色变为无色,并且半分钟之内不恢复红色,若滴定开始和结束时,酸式滴定管中的液面如图所示,则终点读数26.10mL.
(3)数据处理,某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
(4)若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将偏低.(选填“偏高”、“偏低”或“无影响”)
16. 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:250ml容量瓶、胶头滴管、药匙.
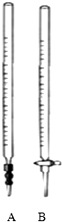
(2)取10.00mL待测液,选择右图中A(填A或B)来移取.
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点.滴定达到终点的标志是:溶液由红色变为无色且半分钟不恢复原色.
(4)根据下列数据,烧碱的纯度为:93.0%(精确到小数点后一位)
(5)判断下列操作引起的误差(填“偏大”、“偏小”或“无影响”)
①滴定前读数正确,滴定终点读数时仰视.偏大.
②未用标准液润洗滴定管.偏大.
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液.偏大.
 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:250ml容量瓶、胶头滴管、药匙.
(2)取10.00mL待测液,选择右图中A(填A或B)来移取.
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点.滴定达到终点的标志是:溶液由红色变为无色且半分钟不恢复原色.
(4)根据下列数据,烧碱的纯度为:93.0%(精确到小数点后一位)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
①滴定前读数正确,滴定终点读数时仰视.偏大.
②未用标准液润洗滴定管.偏大.
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液.偏大.