题目内容
X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法不正确的是( )
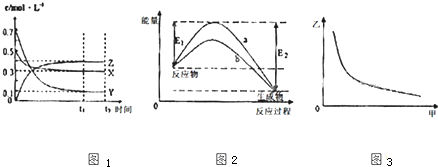

| A、该反应的化学方程式为X(g)+3Y(g)?2Z(g) |
| B、若图Ⅲ中甲表示压强,乙表示Z的含量,则其变化符合图Ⅲ中曲线 |
| C、该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 |
| D、图II中曲线a、b可表示使用不同催化剂的能量变化曲线 |
考点:物质的量或浓度随时间的变化曲线,反应热和焓变,化学平衡的影响因素
专题:图示题
分析:图Ⅰ中X、Y、Z的浓度的变化趋势判断反应物和生成物,根据浓度的变化之比等于化学计量数之比确定反应方程式应为X(g)+3Y(g)?2Z(g),以此来确定A是否正确;
由图Ⅱ可知反应物总能量大于生成物总能量,该反应放热,以此来确定B、C是否正确;
图Ⅲ纵坐标随横坐标的增大而减小,以此来确定D是否正确.
由图Ⅱ可知反应物总能量大于生成物总能量,该反应放热,以此来确定B、C是否正确;
图Ⅲ纵坐标随横坐标的增大而减小,以此来确定D是否正确.
解答:
解:A、图Ⅰ中X、Y的物质的量浓度逐渐减小,应是反应物,Z的物质的量浓度逐渐增大,应是生成物,浓度的变化比值为(0.5-0.3):(0.7-0.1):(0.4-0)=1:3:2,根据浓度的变化之比等于化学计量数之比可知反应方程式应为X(g)+3Y(g)?2Z(g),故A正确;
B、压强增大,平衡右移,Z的含量应增大,故B错误.
C、根据图Ⅱ可知反应物总能量大于生成物总能量,该反应放热,升高温度平衡左移,该反应的平衡常数减小,Y的转化率降低,故C正确;
D、加入催化剂降低反应的活化能,反应热不变,所以图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线,故D正确;
故选B.
B、压强增大,平衡右移,Z的含量应增大,故B错误.
C、根据图Ⅱ可知反应物总能量大于生成物总能量,该反应放热,升高温度平衡左移,该反应的平衡常数减小,Y的转化率降低,故C正确;
D、加入催化剂降低反应的活化能,反应热不变,所以图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线,故D正确;
故选B.
点评:本题考查化学平衡移动问题以及化学反应与能量变化,题目难度不大,注意分析题中曲线的变化特点.

练习册系列答案
相关题目
室温下,下列各组离子在指定溶液中能大量共存的( )
| A、pH=1的溶液中:K+、AlO2-、SO42-、NH4+ |
| B、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C、能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe2+ |
| D、AlCl3溶液中:K+、Na+、SO42-、HCO3- |
0.2mol有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.0.1mol该有机物恰好与4.6g金属钠完全反应.下列关于该有机物的说法不正确的是( )
| A、该化合物的相对分子质量是62 |
| B、该化合物的化学式为C2H6O2 |
| C、1 mol该化合物能与2 mol O2发生催化氧化反应 |
| D、1 mol该有机物最多能与2 mol Na反应 |
下列说法正确的是( )
| A、分子式为C5H12的一氯代物可能有6种结构 |
| B、油脂的种类很多,但它们水解后都有一种相同产物 |
| C、相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗氧气的物质的量更多 |
| D、蚕丝与蜡烛主要成分均为烃类物质 |
下列试剂的保存或使用正确的是( )
| A、实验室的氯水需要保存在棕色试剂瓶中 |
| B、漂白粉比氯水稳定,可露置在空气中 |
| C、称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 |
| D、金属钠可保存在煤油、四氯化碳等有机溶剂中 |
完全相同的两个密闭容器甲和乙,已知甲中装有SO2、O2各1克,乙中装有SO2、O2各2克,在同一温度下反应,2SO2(g)+O2(g)?2SO3(g)达平衡后,甲中SO2的转化率为a%,乙中SO2的转化率为b%,则( )
| A、a%>b% | B、a%<b% |
| C、a%=b% | D、无法判定 |
下列说法正确的是( )
| A、实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B、用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
| C、石油的分馏是物理变化,而煤的干馏是化学变化 |
| D、将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
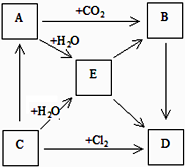 如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.
如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品. (1)铁、铝、铜是人类使用广泛的三种金属.
(1)铁、铝、铜是人类使用广泛的三种金属.