题目内容
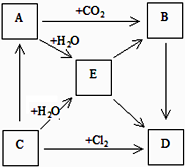 如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.
如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.(1)写出下列转化的化学方程式:
C→A:
C→E:
A→B:
(2)把淡黄色固体A投入酚酞溶液中的现象为
考点:无机物的推断
专题:推断题
分析:A为淡黄色固体,能与CO2、水反应,则A是Na2O2,C是金属单质,可以反应得到A,故C为Na,过氧化钠与水、Na与水反应都得到E,则E为NaOH,C能与氯气反应得到D为NaCl,A和二氧化碳反应生成Na2CO3和O2,B能转化为NaCl,则B是Na2CO3,以此解答该题.
解答:
解:A为淡黄色固体,能与CO2、水反应,则A是Na2O2,C是金属单质,可以反应得到A,故C为Na,过氧化钠与水、Na与水反应都得到E,则E为NaOH,C能与氯气反应得到D为NaCl,A和二氧化碳反应生成Na2CO3和O2,B能转化为NaCl,则B是Na2CO3,
(1)C→A是钠与氧气在加热条件下反应生成过氧化钠,反应方程式为:2Na+O2
Na2O2;
C→E是钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑;
A→B是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na+O2
Na2O2;2Na+2H2O=2NaOH+H2↑;2Na2O2+2CO2=2Na2CO3+O2;
(1)把过氧化钠投入酚酞溶液中,过氧化钠与水反应生成氢氧化钠与氧气,产生气泡,溶液变为红色,过氧化钠具有强氧化性,又是溶液红色褪去,故现象为:产生气泡,无色溶液先变为红色,后褪色,
故答案为:产生气泡,无色溶液先变为红色,后褪色.
(1)C→A是钠与氧气在加热条件下反应生成过氧化钠,反应方程式为:2Na+O2
| ||
C→E是钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑;
A→B是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na+O2
| ||
(1)把过氧化钠投入酚酞溶液中,过氧化钠与水反应生成氢氧化钠与氧气,产生气泡,溶液变为红色,过氧化钠具有强氧化性,又是溶液红色褪去,故现象为:产生气泡,无色溶液先变为红色,后褪色,
故答案为:产生气泡,无色溶液先变为红色,后褪色.
点评:本题考查无机物的推断,侧重于钠及其化合物之间的转化,明确物质的性质是解本题关键,以A的颜色及其特殊的反应来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某温度下对于反应2NO2(g)?N2O4(g);△H<0,在一定密闭容器中达到平衡,下列说法错误的是( )
| A、加压时(容器体积减小),正反速率增大 |
| B、保持压强不变,加入N2,正反速率变小 |
| C、保持压强不变,加入少许N2O4,再达到平衡,颜色变深 |
| D、保持体积不变,升高温度,再达到平衡时,颜色变深 |
X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法不正确的是( )
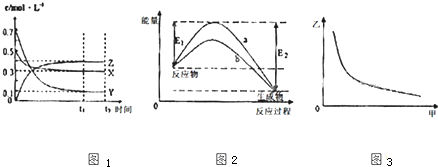

| A、该反应的化学方程式为X(g)+3Y(g)?2Z(g) |
| B、若图Ⅲ中甲表示压强,乙表示Z的含量,则其变化符合图Ⅲ中曲线 |
| C、该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 |
| D、图II中曲线a、b可表示使用不同催化剂的能量变化曲线 |
下列化常用语中,正确的是( )
| A、两个氧分子-O2 |
| B、氢氧化铁的化学式-Fe(OH)3 |
| C、CO2中氧元素的化合价为+2价 |
| D、水通电得到氧气的化学方程式是2H2O=O2↑+2H2↑ |
氢硫酸在空气中有如此反应:2H2S+O2═2S↓+2H2O,下列不正确的是( )
| A、属于置换反应 |
| B、还原性:H2O>H2S |
| C、氧化性:O2>S |
| D、酸性:H2S>H2O |
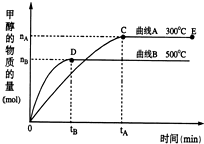 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)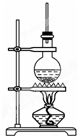 如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下:
如图为硬脂酸甘油酯在碱性条件下水解的装置图,进行皂化反应时的步骤如下: