题目内容
12.某恒定温度下,在一个2L的密闭容器中,加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(?)+2D(?),“?”代表状态不确定,5min后达到平衡,测得生成1.6mol C,且反应的前后压强之比为15:14,则下列说法正确的是( )| A. | 该反应的化学平衡常数表达式是K=[c4(C)•c2(D)]/[c3(A)•c2(B)] | |
| B. | 0~5min内A的反应速率为0.24mol•L-1•min-1 | |
| C. | 此时B的平衡转化率是40% | |
| D. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 |
分析 恒容容器中,气体的压强之比等于气体的物质的量之比,从反应物和生成物的化学计量数和反应前后压强之比可知,C和D中至少有一种物质不是气体,
反应方程式为:3A(g)+2B(g)?4C(?)+2D(?)
反应前(mol) 4 2 0 0
反应了(mol) 1.2 0.8 1.6 0.8
平衡后(mol) 2.8 1.2 1.6 0.8
由气体物质的量之比等于压强之比可得反应后气体物质的量为$\frac{14}{15}$×(4+2)=5.6mol,所以D为气体、C不是气体,据此进行解答.,
A.平衡常数表达式中固体和纯液体不写入表达式;
B.反应速率v=$\frac{△c}{△t}$计算分析;
C.转化率=$\frac{消耗量}{起始量}$×100%;
D.平衡常数随温度变化.
解答 解:A.由于C的状态不是气体,则平衡常数表达式中C不能出现在表达式中,化学平衡常数K=$\frac{{c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$,故A错误;
B.0~5min内A的反应速率=$\frac{\frac{1.2mol}{2L}}{5min}$=0.12mol•L-1•min-1,故B错误;
C.达到平衡时生成1.6molC,B的物质的量为0.8mol,则B的转化率为:$\frac{0.8mol}{2mol}$×100%=40%,故C正确;
D.由由3A(g)+2B(g)?4C(l)+2D(g)达到平衡反应的前后压强之比为15:14,同温同体积条件下,物质的量之比为等于压强之比,即n(前):n(平)=15:14,说明这是个气体体积减少的反应,增大该体系的压强,平衡向右移动,但由于温度没变,化学平衡常数不变,故D错误;
故选C.
点评 本题考查了平衡计算以及平衡常数表达式、转化率、平衡常数的影响因素,题目难度中等,注意掌握化学平衡及其影响因素,明确化学平衡常数的概念及表示方法.

 阅读快车系列答案
阅读快车系列答案| A. | 镍基含铼单晶合金属于混合物 | |
| B. | ${\;}_{75}^{185}$Re和${\;}_{75}^{187}$Re互称为核素 | |
| C. | 铼(Re)元素的相对原子质量为186 | |
| D. | 含铼合金比纯铼的熔点高、硬度大 |
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-) | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) |
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+ |
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
| A. | 正极为铜,负极为铁,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
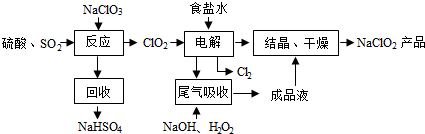
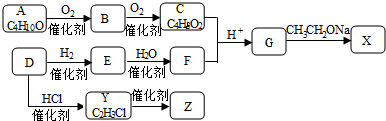
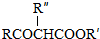
 ;
; ,反应类型是取代反应;
,反应类型是取代反应;