题目内容
14.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: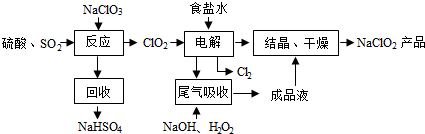
回答下列问题:
(1)NaClO2中Cl的化合价为+3价.
(2)写出“反应”步骤中生成ClO2的化学方程式2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2.
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为NaOH溶液、Na2CO3溶液.“电解”中阴极反应的主要产物是ClO2-(或NaClO2).
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2.此吸收反应中,氧化剂与还原剂的物质的量之比为2:1,该反应中氧化产物是O2.
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.NaClO2的有效氯含量为1.57.(计算结果保留两位小数)
分析 (1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0计算得到;
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒和原子守恒配平书写化学方程式;
(3)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,ClO2氧化能力强,根据结晶干燥后的产物可知ClO2的还原产物为NaClO2;
(4)依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2-,则此反应中ClO2为氧化剂,还原产物为ClO2-,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,每摩尔H2O2得到2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比;
(5)每克NaClO2的物质的量$\frac{1g}{90.5g/mol}$=$\frac{1}{90.5}$mol,依据电子转移数目相等,可知氯气的物质的量为$\frac{1}{90.5}$mol×4×$\frac{1}{2}$=$\frac{2}{90.5}$mol,计算得到氯气的质量.
解答 解:(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价,
故答案为:+3;
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2,
故答案为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;
(3)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,ClO2氧化能力强,根据结晶干燥后的产物可知ClO2的还原产物为NaClO2,因此电解装置中阴极ClO2得电子生成ClO2-,阳极Cl-失电子生成Cl2.
故答案为:NaOH溶液;Na2CO3溶液;ClO2-(或NaClO2);
(4)依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2-,则此反应中ClO2为氧化剂,还原产物为ClO2-,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,每摩尔H2O2得到2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,
故答案为:2:1;O2;
(5)1gNaClO2的物质的量$\frac{1g}{90.5g/mol}$=$\frac{1}{90.5}$mol,依据电子转移数目相等,NaClO2~Cl-~4e-,Cl2~2Cl-~2e-,可知氯气的物质的量为$\frac{1}{90.5}$mol×4×$\frac{1}{2}$=$\frac{2}{90.5}$mol,则氯气的质量为$\frac{2}{90.5}$mol×71g/mol=1.57g,
故答案为:1.57g.
点评 本题考查了物质制备的实验方法分析、氧化还原反应概念分析和电子转移的计算、注意物质性质的理解应用,题目难度中等.

| A. | 氧气比臭氧稳定 | |
| B. | 所有吸热反应不一定都要加热反应才能进行 | |
| C. | 断裂3mol氧气中的化学键吸收的能量大于形成2mol臭氧中的化学键放出的能量 | |
| D. | 3mol氧气的总能量比2mol臭氧的总能量高 |
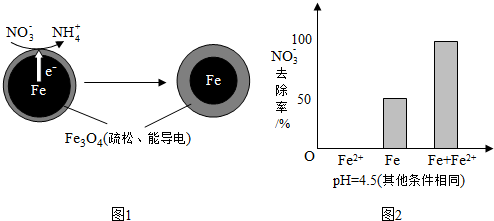
(1)Fe还原水体中NO3-的反应原理如图1所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 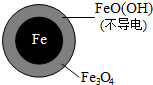 |  |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
(4)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
| A. | 该反应的化学平衡常数表达式是K=[c4(C)•c2(D)]/[c3(A)•c2(B)] | |
| B. | 0~5min内A的反应速率为0.24mol•L-1•min-1 | |
| C. | 此时B的平衡转化率是40% | |
| D. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 |

 (R、R′为烃基)
(R、R′为烃基) ,D的化学式为C8H11O2Na.
,D的化学式为C8H11O2Na. .
. .
. .
.



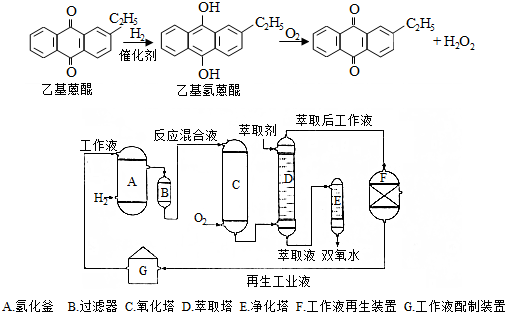
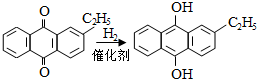 .进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.
.进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌. 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题: