题目内容
下列离子方程式书写正确的是( )
A、把铜片放入浓硫酸中并加热Cu+4H++S
| ||
B、碳酸钙与盐酸反应C
| ||
C、碳酸氢钠溶液和过量盐酸混合HCO
| ||
D、硫酸铜溶液与氢氧化钡溶液反应Ba2++OH-+H++S
|
考点:离子方程式的书写
专题:离子反应专题
分析:A、铜与浓硫酸的离子方程式中,浓硫酸需要保留化学式,反应需要加热才能进行;
B、碳酸钙为难溶物,离子方程式中应该保留化学式;
C、碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,碳酸氢根离子写成整体;
D、硫酸铜与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀.
B、碳酸钙为难溶物,离子方程式中应该保留化学式;
C、碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水,碳酸氢根离子写成整体;
D、硫酸铜与氢氧化钡溶液反应生成硫酸钡和氢氧化铜沉淀.
解答:
解:A、铜片与浓硫酸反应需要加热,浓硫酸在离子方程式中需要保留分子式,该反应的离子方程式为:Cu+2H2SO4(浓)
Cu2++SO42-+2SO2↑+2H2O,故A错误;
B、碳酸钙难溶,和盐酸反应生成氯化钙、水、二氧化碳;反应的离子方程式为:CaCO3+2H+=CO2↑+H2O+Ca2+,故B错误;
C、碳酸氢钠溶液和过量盐酸混合,反应生成二氧化碳和水,反应的离子方程式为:HCO3-+OH-═H2O+CO32-,故C正确;
D、硫酸铜溶液与氢氧化钡溶液反应生成氢氧化铜和硫酸钡,反应离子方程式为:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓,故D错误;
故选C.
| ||
B、碳酸钙难溶,和盐酸反应生成氯化钙、水、二氧化碳;反应的离子方程式为:CaCO3+2H+=CO2↑+H2O+Ca2+,故B错误;
C、碳酸氢钠溶液和过量盐酸混合,反应生成二氧化碳和水,反应的离子方程式为:HCO3-+OH-═H2O+CO32-,故C正确;
D、硫酸铜溶液与氢氧化钡溶液反应生成氢氧化铜和硫酸钡,反应离子方程式为:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓,故D错误;
故选C.
点评:本题考查了离子反应的书写判断,明确发生的化学反应为解答的关键,侧重基础知识的考查,注意掌握常见的离子反应书写方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
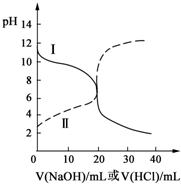 25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线Ⅰ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D、曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
设NA代表阿伏加德罗常数.下列叙述正确的是( )
| A、标准状况下2.24 L H2O中,分子数为0.1NA |
| B、1 L 0.5mol?L-1 AlCl3溶液中含有的Al3+数为0.5 NA |
| C、常温常压下16g O2中,氧原子数为NA |
| D、0.1mol 铁粉与足量的盐酸充分反应,转移的电子数为0.3NA |
浓度均为0.1mol/L的NaOH溶液与氨水相比较,下列结论正确的是( )
| A、NaOH溶液中c(H+)小 |
| B、两溶液中所含的OH-数目相同 |
| C、氨水中c(OH-)大 |
| D、中和HCl的物质的量相同 |
能正确表示下列反应的离子方程式的是( )
| A、FeCl2溶液中通入Cl2:Fe2++Cl2=2Cl-+Fe3+ |
| B、铝和烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| C、Fe投入盐酸中:2Fe+6H+=2Fe3++3H2↑ |
| D、碳酸氢镁与足量的NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓ |
下列装置能达到实验目的是( )
A、 此图用于放出碘的四氯化碳溶液 |
B、 此图用于实验室收集SO2 |
C、 此图用于实验室制备Fe(OH)2 |
D、 此图用于比较NaHCO3和Na2CO3热稳定性 |
下列离子方程式正确的是( )
| A、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | ||
B、甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-
| ||
C、乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH-
| ||
| D、向小苏打溶液中加入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知:①甲、乙、丙均为前三周期元素的单质,常温下均为气态,丁是日常生活中的一种常见金属;②常温下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色.请回答:
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知:①甲、乙、丙均为前三周期元素的单质,常温下均为气态,丁是日常生活中的一种常见金属;②常温下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色.请回答: