题目内容
(一)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,通过测定褪色所需时间来判断反应的快慢.限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L 酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表.该小组设计了如下的方案.
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4.为了观察到
紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:
n(H2C2O4):n (KMnO4)≥ .
(2)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小
变化,这段时间内平均反应速率v(KMnO4)= mol?L-1?min-1.
(3)请完成表格内五处空白.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图1,其中反应速率最快的阶段是 ,原因是 .
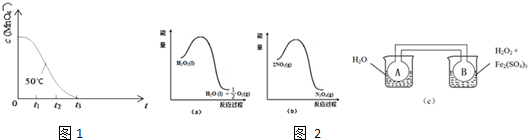
(二)利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 .
| 物理量 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | |||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | |||
| ① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| ② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.010 | 4.0 | 25 | |||
紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:
n(H2C2O4):n (KMnO4)≥
(2)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小
变化,这段时间内平均反应速率v(KMnO4)=
(3)请完成表格内五处空白.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图1,其中反应速率最快的阶段是

(二)利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的
考点:探究温度、压强对化学反应速率的影响
专题:
分析:(一)(1)根据“观察到紫色褪去”必须满足高锰酸钾的物质的量小于草酸的物质的量解得二者浓度关系;
(2)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(3)由于高锰酸钾和草酸的浓度均相同,为了探究不同浓度对反映速率的影响,需要加水改变草酸的浓度;
(4)从图象可以看出t1-t2阶段斜率最大,c(MnO4-)变化最大,说明此时段反应速率最快,由于浓度变小,可以推测是催化剂的影响;
(二)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动.
(2)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(3)由于高锰酸钾和草酸的浓度均相同,为了探究不同浓度对反映速率的影响,需要加水改变草酸的浓度;
(4)从图象可以看出t1-t2阶段斜率最大,c(MnO4-)变化最大,说明此时段反应速率最快,由于浓度变小,可以推测是催化剂的影响;
(二)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动.
解答:
解:(一)(1)H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即c(H2C2O4):c(KMnO4)≥
=2.5,
故答案为:2.5;
(2)草酸的物质的量为:0.10mol?L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol?L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:
=
×0.010mol/L,
这段时间内平均反应速率v(KMnO4)=
=0.010mol?L-1?min-1=1.0×10-2mol?L-1?min-1,
故答案为:0.010或1.0×10-2;
(3)三组实验中高锰酸钾的浓度、体积均相等,为了探究草酸浓度对反应速率的影响,可以加蒸馏水来改变草酸的浓度,所以,第一列的物理量为蒸馏水,实验③可以加1mL的蒸馏水改变草酸的浓度,以便与实验②作对比,补充完整为:
故答案为:
;
(4)从图象可以看出t1-t2阶段斜率最大,c(MnO4-)变化最大,说明此时段反应速率最快,由于反应物的浓度变小,可以推测是催化剂的影响,可推测是生成物做了催化剂,
故答案为:t1-t2;生成物MnSO4是该反应的催化剂;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;2NO2(红棕色)?N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深.
| 5 |
| 2 |
故答案为:2.5;
(2)草酸的物质的量为:0.10mol?L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol?L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:
| 0.010mol/L×0.004L |
| 0.002L+0.004L |
| 2 |
| 3 |
这段时间内平均反应速率v(KMnO4)=
| ||
|
故答案为:0.010或1.0×10-2;
(3)三组实验中高锰酸钾的浓度、体积均相等,为了探究草酸浓度对反应速率的影响,可以加蒸馏水来改变草酸的浓度,所以,第一列的物理量为蒸馏水,实验③可以加1mL的蒸馏水改变草酸的浓度,以便与实验②作对比,补充完整为:
| 物理量 | 蒸馏水 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 体积(mL) | 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| ② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 1.0 | 0.20 | 1.0 | 0.010 | 4.0 | 25 |
| 物理量 | 蒸馏水 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 体积(mL) | 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
| ② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 1.0 | 0.20 | 1.0 | 0.010 | 4.0 | 25 |
(4)从图象可以看出t1-t2阶段斜率最大,c(MnO4-)变化最大,说明此时段反应速率最快,由于反应物的浓度变小,可以推测是催化剂的影响,可推测是生成物做了催化剂,
故答案为:t1-t2;生成物MnSO4是该反应的催化剂;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;2NO2(红棕色)?N2O4(无色),△H<0是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深.
点评:本题考查氧化还原反应、反应速率影响因素实验、化学平衡移动等,侧重对学生综合能力的考查,需要学生具备扎实的基础,注意利用控制变量法测定外界条件对反应速率的影响,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列盐酸参与的反应中,HCl被氧化的是( )
| A、NaOH+HCl=NaCl+H2O | ||||
| B、Fe+2HCl=FeCl2+H2↑ | ||||
| C、CuO+2HCl=CuCl2+H2 O | ||||
D、MnO2+4HCl(浓)
|
一氧化碳中毒,是由于一氧化碳跟血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,人因缺少氧气而窒息,甚至死亡.这个反应可表示如下:(血红蛋白-O2)+CO?(血红蛋白-CO)+O2,抢救中毒者采取的措施不正确的是( )
| A、立即打开门窗通风 |
| B、将中毒者转移到空旷的地带 |
| C、立即打开排气扇将CO排出 |
| D、给危重病人及时输氧 |