题目内容
现有0.1mol/L的FeCl3溶液,请回答下列问题.
(1)当使溶液的pH=4时,能否有Fe(OH)3沉淀生成{已知该温度下Ksp[Fe(OH)3]=2.6×10-20}
(2)pH=4时,铁离子能否完全沉淀?(当浓度小于1×10-5mol/L时,认为完全沉淀)
(3)若FeCl3和CuCl2的混合液,其浓度均为0.1mol/L,当使pH=4时,能否使二者完全分离开?(已知该温度下Ksp[Cu﹙OH﹚2]=2.2×10-20)
(1)当使溶液的pH=4时,能否有Fe(OH)3沉淀生成{已知该温度下Ksp[Fe(OH)3]=2.6×10-20}
(2)pH=4时,铁离子能否完全沉淀?(当浓度小于1×10-5mol/L时,认为完全沉淀)
(3)若FeCl3和CuCl2的混合液,其浓度均为0.1mol/L,当使pH=4时,能否使二者完全分离开?(已知该温度下Ksp[Cu﹙OH﹚2]=2.2×10-20)
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:依据pH计算出此时氢氧根的浓度,然后依据溶度积分别进行计算,再判断即可.
解答:
解:(1)pH=4,即c(H+)=10-4,那么c(OH-)=10-10;c(Fe3+)?c3(OH-)=0.1×(10-10)3=10-31<2.6×10-20,所以没有沉淀析出,答:无沉淀;
(2)依据(1)计算得出pH=4时,无沉淀生成,故沉淀不能完全,答:不完全;
(3)c(OH-)=10-10,故Qc[Cu﹙OH﹚2]=0.1×10-20=1.0×10-21<Ksp[Cu﹙OH﹚2],故Cu﹙OH﹚2]沉淀完全,故能完全分离,答:能使二者完全分离.
(2)依据(1)计算得出pH=4时,无沉淀生成,故沉淀不能完全,答:不完全;
(3)c(OH-)=10-10,故Qc[Cu﹙OH﹚2]=0.1×10-20=1.0×10-21<Ksp[Cu﹙OH﹚2],故Cu﹙OH﹚2]沉淀完全,故能完全分离,答:能使二者完全分离.
点评:本题考查了溶度积常数计算应用、沉淀转化关系的分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
若溶液中由水电离产生的c(OH-)=1×10-14mol?L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+ Na+NO3- Cl- |
| B、K+ Na+Cl- NO3- |
| C、K+ Na+ Cl-AlO2- |
| D、K+ NH4+ SO42-NO3- |
下列有关生活常识的说法中,正确的是( )
| A、用完后的废电池应该集中回收处理 |
| B、天然果汁中不含任何化学物质 |
| C、“绿色食品”指颜色为绿色的食品 |
| D、“白色污染”是白色粉尘造成的污染 |
下列对进行焰色反应的实验操作注意事项的说明,正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先灼烧铂丝到火焰呈原色时,再蘸被检验物质
③每次实验后都要将铂丝蘸稀硫酸后灼烧至火焰呈无色为止
④没有铂丝可用无锈铁丝代替.
①钾的火焰颜色要透过蓝色钴玻璃观察
②先灼烧铂丝到火焰呈原色时,再蘸被检验物质
③每次实验后都要将铂丝蘸稀硫酸后灼烧至火焰呈无色为止
④没有铂丝可用无锈铁丝代替.
| A、仅③不正确 |
| B、仅④不正确 |
| C、③④不正确 |
| D、②③④不正确 |
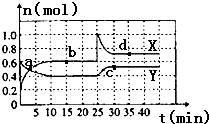 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入容积为2L的恒温密闭容器中,各组分物质的量随时间变化关系如图所示.
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入容积为2L的恒温密闭容器中,各组分物质的量随时间变化关系如图所示.