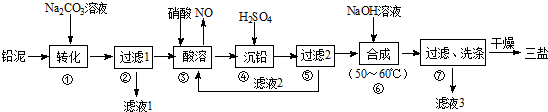
题目内容
9.氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:(1)该化学反应的平衡常数为4.5×10-4.
(2)该反应的离子方程式为Cl2+H2O?H++Cl-+HClO;它的平衡常数的表达式为$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$
(3)如果增大氯气的压强,氯气在水中的溶解度将增大(填“增大”、“减小”或“不变”),平衡将向右移动(填“向右移动”、“向左移动”或“不移动”).
(4)已知:H2CO3═HCO3-+H+ Ka1(H2CO3)=4.45×10-7
HCO3-═CO32-+H+ Ka2(H2CO3)=5.61×10-11
HClO═H++ClO- Ka(HClO)=2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:将少量的氯气通入到过量的碳酸钠溶液中Cl2+2CO32-+H2O=Cl-+ClO-+2HCO3-.
分析 (1)在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;结合平衡计算平衡状态微粒的浓度,依据平衡常数概念计算得到;
(2)氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质,化学平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,注意固体和纯液体不写入表达式;
(3)气体溶解度随压强增大会增大,平衡向气体体积减小的方向进行;
(4)依据电离平衡常数判断出的酸性H2CO3 >HClO>HCO3-;依据酸性强弱分析反应产物.
解答 解:(1)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,溶于水的Cl2约有三分之一与水反应反应的氯气为0.03mol,
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09 0 0 0
转化浓度:0.03 0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03 0.03
K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$=$\frac{0.0{3}^{3}}{0.06}$=4.5×10-4,
故答案为:4.5×10-4;
(2)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,平衡常数表达式K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$,
故答案为:Cl2+H2O?H++Cl-+HClO,$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$;
(3)在上述平衡中加压,平衡向气体体积减小的反应方向进行,平衡都向正反应方向移动,氯气的溶解量会增加,
故答案为:增大;向右移动;
(4)将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,反应的离子方程式为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-,
故答案为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-.
点评 本题考查了氯气性质、化学平衡的影响因素影响、平衡计算应用、Cl2溶于水的离子反应方程式,其中平衡常数的大小比较、压强对平衡移动的影响判断是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 保证装置不漏气 | |
| B. | 镁带称量后,用砂皮擦去表面的氧化层 | |
| C. | 用针筒注入硫酸后,拔出速度要快 | |
| D. | 镁带的质量要使产生的氢气足以计量 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是H、F、Cl(填写元素符号).
(2)①和④号元素形成的化合物的化学式为NH3,用电子式表示其形成过程为
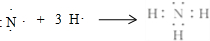 .
.(3)⑧号元素的最高价氧化物的水化物的化学式是Mg(OH)2.
(4)①、⑤、⑦号元素形成的一种化合物的电子式是
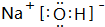 ,在该化合物中既含有离子键,又含有共价键.
,在该化合物中既含有离子键,又含有共价键. | A. | NaHCO3溶于水:NaHCO3═Na++H++CO32- | |
| B. | H2CO3?2H++CO32- | |
| C. | Al(OH)3酸式电离:Al(OH)3═H2O+AlO2-+H+ | |
| D. | NaHSO4熔化:NaHSO4═Na++HSO4- |
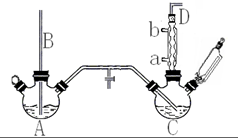 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”) 处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;HCl+NaOH=NaCl+H2O(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
| A. | NaOH | B. | NaClO | C. | NaCl | D. | Cl2 |
| A. | 1.0 mol/L | B. | 2.0 mol/L | C. | 3.0 mol/L | D. | 4.0 mol/L |
| A. | 由H原子形成1 mol H-H键要吸收能量 | |
| B. | 所有燃烧的反应都是放热反应 | |
| C. | NaOH溶于水是放热反应 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |