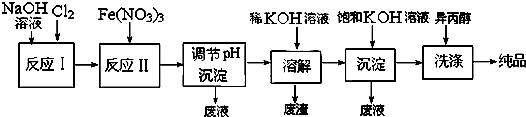
题目内容
下列现象或反应的原理解释正确的是( )
| 现象或反应 | 原理解释 | |
| A | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面生成的氧化物具有高熔点 |
| B | 钠和氧气在加热条件下进行反应 | 该反应为吸热反应 |
| C | 碳酸钠和氢氧化钠溶液中滴加酚酞,溶液都呈红色 | 碳酸钠和氢氧化钠都是碱 |
| D | 铁制容器可用于盛装冷的浓硫酸 | 铁与浓硫酸不反应 |
| A、A | B、B | C、C | D、D |
考点:铝的化学性质,钠的化学性质,钠的重要化合物,铁的化学性质
专题:元素及其化合物
分析:A.Al燃烧生成的氧化铝的熔点高;
B.钠和氧气在加热条件下进行反应,属于放热反应;
C.碳酸钠水解使得溶液呈碱性,碳酸钠属于盐;
D.铁遇到冷的浓硫酸发生钝化.
B.钠和氧气在加热条件下进行反应,属于放热反应;
C.碳酸钠水解使得溶液呈碱性,碳酸钠属于盐;
D.铁遇到冷的浓硫酸发生钝化.
解答:
解:A.Al燃烧生成的氧化铝的熔点高,所以铝箔在酒精灯火焰上加热熔化不滴落,故A正确;
B.一个化学反应是吸热反应还是放热反应与反应条件无关,钠和氧气在加热条件下进行反应,属于放热反应,故B错误;
C.碳酸钠水解使得溶液呈碱性,碳酸钠属于盐,故C错误;
D.铁遇到冷的浓硫酸发生了化学反应,出现了钝化现象,故D错误;
故选A.
B.一个化学反应是吸热反应还是放热反应与反应条件无关,钠和氧气在加热条件下进行反应,属于放热反应,故B错误;
C.碳酸钠水解使得溶液呈碱性,碳酸钠属于盐,故C错误;
D.铁遇到冷的浓硫酸发生了化学反应,出现了钝化现象,故D错误;
故选A.
点评:本题考查化学实验分析评价,涉及Al及其化合物的性质、钠及其化合物的性质、盐类的水解、钝化现象等,侧重对物质的性质的考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
若NA代表阿伏加德罗常数,则下列叙述正确的是( )
| A、16g氧气和臭氧的混合物中原子的数目0.5NA |
| B、1mol Cl2与足量的铁完全反应,转移的电子数为2NA |
| C、1 L 0.5mol?L-1 AlCl3溶液中含有的Al3+数目为0.5NA |
| D、在标准状况下,22.4L HCl与22.4L H2O2所含有的电子数均为18 NA |
下列说法正确的是( )
| A、一定温度下,将盐酸滴加入醋酸钠溶液中至呈中性.此时溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
| B、常温下,将0.1 mol?L-1氨水稀释10倍后,其pH大于12 |
| C、常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=4.9×10-5,则反应CaSO4(s)+CO32- (aq)═CaCO3(s)+SO42-(aq) 平衡常数K约为1.75×10-4 |
| D、溶有等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) |
下列说法正确的是( )
| A、在酸碱中和滴定实验中可用传感技术绘制中和滴定曲线 |
| B、向试管中加入4mL 0.1mol?L-1K2Cr2O7溶液,再滴加数滴1 mol?L-1NaOH溶液,溶液颜色由黄色变为橙色 |
| C、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加入2mL的水,以防过滤时烧杯中的硝酸钾晶体过早析出 |
| D、蒸馏时温度计水银球插在蒸馏烧瓶支管口的下方位置,将收集到高沸点馏分 |
甲-辛等八种元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断不正确的是( )
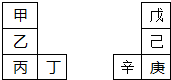

| A、乙的单质在空气中燃烧生成只含离子键的化合物 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、最高价氧化物的水化物的碱性:丙>乙>甲 |
下列离子或分子在给定的条件下一定能大量共存的是( )
| A、由水电离的c(H+)=1×10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| B、使甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
| C、pH=10的溶液中:Na+、Cl-、SO42-、NO3- |
| D、含有CO32-的溶液中:K+、C6H5OH、Cl2、SO42- |
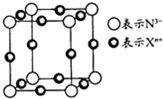 如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )
如图为某晶胞结构,其中Xn+中K、L、M三个电子层均填满电子,下列有关说法正确的是( )| A、该晶体的化学式是Cu3N |
| B、Xn+离子中n=2 |
| C、X是第三周期元素 |
| D、在晶体中,N3-的配位数为3 |
 将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是( )
将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是( )