题目内容
若NA代表阿伏加德罗常数,则下列叙述正确的是( )
| A、16g氧气和臭氧的混合物中原子的数目0.5NA |
| B、1mol Cl2与足量的铁完全反应,转移的电子数为2NA |
| C、1 L 0.5mol?L-1 AlCl3溶液中含有的Al3+数目为0.5NA |
| D、在标准状况下,22.4L HCl与22.4L H2O2所含有的电子数均为18 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氧气和臭氧都是由氧原子构成,依据n=
计算16g混合物含氧元素的量解答;
B.铁与氯气反应生成氯化铁;
C.铝离子为弱碱阳离子,水解生成氢氧化铝;
D.气体摩尔体积只适用于气体.
| m |
| M |
B.铁与氯气反应生成氯化铁;
C.铝离子为弱碱阳离子,水解生成氢氧化铝;
D.气体摩尔体积只适用于气体.
解答:
解:A.16g氧气和臭氧的混合物中,含O的物质的量n(O)=
=1mol,个数为1mol×NA=NA,故A错误;
B.铁与氯气反应生成氯化铁,1mol Cl2与足量的铁完全反应,氯气完全反应转化成2molCl-,转移电子数2NA,故B正确;
C.AlCl3溶液中含氯化铝的物质的量为1 L×0.5mol?L-1=0.5mol,但是铝离子为弱碱阳离子,部分水解生成氢氧化铝,所以溶液中铝离子的物质的量小于0.5mol,个数小于0.5NA,故C错误;
D.H2O2在标准状况下为液态,不适用气体摩尔体积,故D错误;
故选:B.
| 16g |
| 16g/mol |
B.铁与氯气反应生成氯化铁,1mol Cl2与足量的铁完全反应,氯气完全反应转化成2molCl-,转移电子数2NA,故B正确;
C.AlCl3溶液中含氯化铝的物质的量为1 L×0.5mol?L-1=0.5mol,但是铝离子为弱碱阳离子,部分水解生成氢氧化铝,所以溶液中铝离子的物质的量小于0.5mol,个数小于0.5NA,故C错误;
D.H2O2在标准状况下为液态,不适用气体摩尔体积,故D错误;
故选:B.
点评:本题考查了阿伏伽德罗的应用,题目难度不大,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积等之间的转化关系是解题关键,注意气体摩尔体积的使用对象为气体.

练习册系列答案
相关题目
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子;A与C,B与D均为同主族元素.下列叙述正确的是( )
| A、B元素组成的一种单质具有漂白性,能使KMnO4溶液紫色褪去 |
| B、B、D两种元素形成的一种化合物也具有一定的漂白性,能使紫色石蕊紫色褪去 |
| C、C元素分别与A元素和B元素形成的化合物都是离子晶体,一定均与水反应生成强碱和无色气体 |
| D、A2B的热稳定性强于A2D、沸点也高于A2D,但解释的理由不相同 |
下列离子方程式中,不正确的是( )
| A、向NaHSO4溶液中加入过量的Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B、向Fe(OH)3中加入过量的HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
| C、用淀粉碘化钾试纸和盐酸检验加碘盐:IO3-+5I-+6H+=3I2+3H2O |
| D、将少量SO2气体通入足量的NaClO溶液中:SO2+ClO-+H2O=SO42-+Cl-+2H+ |
设NA代表阿伏伽德罗常数,下列说法正确的是( )
| A、1molNa2O2中含4NA个离子 |
| B、常温常压下,46gNO2和N2O4混合物含有原子数为3NA |
| C、标准状况下,22.4LCHCl3中含有的氯原子数为3NA |
| D、18gD2O中含有的质子数为10NA |
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述中正确的是( )
| A、在使用过程中,电池负极区溶液的pH减小 |
| B、使用过程中,电子由Ag20极经外电路流向Zn极 |
| C、Zn是正极,Ag2O是负极 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
下列是四位同学对“化学与健康”这一话题发表的见解,其中正确的是( )
| A、维生素在天然食品中含量丰富,所以加工后的食品中维生素含量也高 |
| B、人体细胞中的酸碱平衡是不能通过选择食物调节的 |
| C、为了食品安全,我国应该禁止使用食品防腐剂 |
| D、食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 |
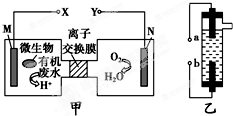 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )| A、装置乙的a极要与装置甲的X极连接 |
| B、装置乙中b极的电极反应式为2Cl--2e-═Cl2↑ |
| C、若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、N电极发生还原反应,当N电极消耗5.6 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是