题目内容
已知下列热化学方程式则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变△H为( )
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)H2(g)+
O2(g)═H2O(l)△H3=-285.8kJ?mol-1.
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)H2(g)+
| 1 |
| 2 |
| A、488.3kJ?mol-1 |
| B、-244.15kJ?mol-1 |
| C、244.15kJ?mol-1 |
| D、-488.3kJ?mol-1 |
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:根据盖斯定律构造出目标反应热化学反应方程式,据此判断.注意化学计量数乘以不同的系数,进行加减,焓变也要乘以相同的系数,做相应加减.
解答:
解:(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)H2(g)+
O2(g)=H2O(l)△H3=-285.8kJ/mol
根据盖斯定律,(1)×2+(3)×2-(2)得2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol.
故选D.
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=-870.3kJ/mol
(3)H2(g)+
| 1 |
| 2 |
根据盖斯定律,(1)×2+(3)×2-(2)得2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol.
故选D.
点评:本题考查反应热的计算,题目难度不大,注意盖斯定律的理解与应用.盖斯定律只适用于等温等压或等温等容过程,各步反应的温度应相同.

练习册系列答案
相关题目
下列关于盖斯定律描述不正确的是( )
| A、化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B、盖斯定律遵守能量守恒定律 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、利用盖斯定律可以计算有副反应发生的反应的反应热 |
 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图是向10mL AgNO3溶液中逐渐加入0.1mol?L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图是向10mL AgNO3溶液中逐渐加入0.1mol?L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A、原AgNO3溶液的物质的量浓度为1mol?L-1 |
| B、图中x点的坐标为(100,6) |
| C、若升高温度,图象不会发生变化 |
| D、把0.1mol?L-1的NaCl换成0.1mol?L-1 NaI则图象在终点后变为虚线部分 |
 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
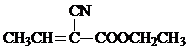 )是合成某种手术用粘合剂的单体,X的合成路线如下:
)是合成某种手术用粘合剂的单体,X的合成路线如下: