题目内容
20.下列性质递变规律错误的是( )| A. | 金属性:K>Na>Li | B. | 酸性:HClO3>H2SO4>H3PO4 | ||
| C. | 还原性:I->Br->Cl- | D. | 氧化性:F2>Cl2>Br2 |
分析 A.同一主族元素中,原子序数越大,金属性越强;
B.非金属性越强,最高价氧化物对应水合物的酸性越强,但是HClO3为不是氯元素的最高价含氧酸;
C.非金属性越强,对应离子的还原性越弱;
D.一般情况下非金属性越强,单质的氧化性越强.
解答 解:A.碱金属元素中,原子序数越大,金属性越强,原子序数K>Na>Li,则金属性:K>Na>Li,故A正确;
B.HClO3不是Cl元素的最高价含氧酸,不能根据元素周期律判断其酸性强弱,故B错误;
C.非金属性I<Br<Cl,非金属性越强,对应离子的还原性越弱,则离子还原性大小为:I->Br->Cl-,故C正确;
D.非金属性:F>Cl>Br,非金属性越强,对应单质的氧化性越强,则氧化性:F2>Cl2>Br2,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
10.下列说法正确的是( )
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 在共价化合物中一定存在共价键 | |
| C. | N2和CH4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物一定只含离子键 |
11.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 上述现象说明[Cu(NH3)4]2+不如Cu(OH)2稳定 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤电子对,NH3提供空轨道 |
8.下列物质的电子式书写正确的是( )
| A. | H:F | B. | 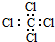 | C. | 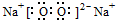 | D. | 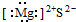 |
15.下列关于元素周期表的叙述,错误的是( )
| A. | 第IA族元素全部是金属元素 | |
| B. | 过渡元素全是金属元素 | |
| C. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 在元素周期表中金属与非金属的分界线附近可以寻找制造半导体的材料 |
5.下列各对物质中互为同系物的是( )
| A. | CH≡CH和CH2═CH-CH═CH2 | B. | CH3-CH═CH2和CH3-CH2-CH═CH2 | ||
| C. | CH3-CH3和CH3-CH═CH2 | D. | 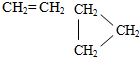 |