题目内容
用15.8g KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸.反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)该盐酸的物质的量浓度为
(2)该反应过程中电子转移总数为
(3)该反应过程中有 摩HCl被氧化?
(4)产生的Cl2在标准状况下的体积为 .
(1)该盐酸的物质的量浓度为
(2)该反应过程中电子转移总数为
(3)该反应过程中有
(4)产生的Cl2在标准状况下的体积为
考点:氧化还原反应的计算
专题:
分析:(1)盐酸的物质的量浓度=
;
(2)n(KMnO4)=
=0.1mol,根据KMnO4和转移电子之间的关系式计算;
(3)根据方程式知,参加反应的HCl有
被氧化,由KMnO4和HCl之间的关系式计算;
(4)KMnO4和氯气之间的关系式计算氯气体积.
| 103ρω |
| M |
(2)n(KMnO4)=
| 15.8g |
| 158g/mol |
(3)根据方程式知,参加反应的HCl有
| 5 |
| 8 |
(4)KMnO4和氯气之间的关系式计算氯气体积.
解答:
解:(1)盐酸的物质的量浓度=
=
mol/L=11.9mol/L,故答案为:11.9mol/L;
(2)n(KMnO4)=
=0.1mol,该反应中Mn元素化合价由+7价变为+2价,所以转移电子的物质的量=0.1mol×(7-2)=0.5mol,其转移电子个数为3.01×1023,故答案为:3.01×1023;
(3)根据方程式知,参加反应的HCl有
被氧化,设参加氧化还原反应 的HCl物质的量为x,
2KMnO4+10HCl(被氧化)+6HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 10mol
0.1mol x
2mol:10mol=0.1mol:x
x=
=0.5mol,
故答案为:0.5;
(4)设生成氯气体积为y,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 112L
0.1mol y
2mol:112L=0.1mol:y
y=
=5.6L
故答案为:5.6L.
| 103ρω |
| M |
| 103×1.19×36.5% |
| 36.5 |
(2)n(KMnO4)=
| 15.8g |
| 158g/mol |
(3)根据方程式知,参加反应的HCl有
| 5 |
| 8 |
2KMnO4+10HCl(被氧化)+6HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 10mol
0.1mol x
2mol:10mol=0.1mol:x
x=
| 10mol×0.1mol |
| 2mol |
故答案为:0.5;
(4)设生成氯气体积为y,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 112L
0.1mol y
2mol:112L=0.1mol:y
y=
| 112L×0.1mol |
| 2mol |
故答案为:5.6L.
点评:本题考查氧化还原反应的计算,明确方程式中各个物理量之间的关系式是解本题关键,侧重考查计算能力,注意参加反应的HCl有一部分被氧化,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列气体中能用浓硫酸干燥的是( )
| A、H2S |
| B、NH3 |
| C、HI |
| D、CO2 |
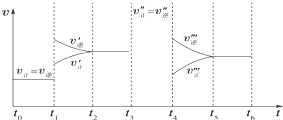 密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )
密闭容器中发生如下反应:A(g)+3B(g)?2C(g);△H<0,根据下列速率-时间图象,下列说法不正确的是( )| A、下列时刻所改变的外界条件是:t1升温;t3加催化剂;t4减压 |
| B、产物C的体积分数最大的时间段是t0~t1段 |
| C、上述图象中C的体积分数相等的时间段是t2~t3段与t3~t4段 |
| D、反应速率最大的时间段是t0~t1段 |
在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4.能使溶液的导电能力增强的是( )
| A、①② | B、②④ | C、①④ | D、③④ |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,有关说法正确的是( )
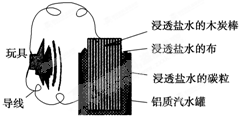

| A、铝罐将逐渐被腐蚀 |
| B、碳粒和炭棒上发生的反应为O2+4e-═2O2- |
| C、炭棒应与玩具电机的负极相连 |
| D、该电池工作一段时间后炭棒和碳粒的质量会减轻 |
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:1的是( )
A、 |
B、 |
C、 |
D、 |