题目内容
4.工业上使用漂白粉时加入少量的盐酸会可提高(填“提高”或“降低”)漂白能力,涉及到的化学方程式Ca(ClO)2+2HCl=CaCl2+2HClO.分析 漂白粉的有效成分为次氯酸钙,可与酸反应生成具有漂白性的次氯酸,则增强漂白能力,应加入酸,以此解答.
解答 解:白粉是混合物,主要成分是Ca(ClO)2和CaCl2,有效成分是Ca(ClO)2,氯酸钙可与酸反应生成具有漂白性的次氯酸,则增强漂白能力,应加入酸,
发生Ca(ClO)2+2HCl=CaCl2+2HClO,
故答案为:提高;Ca(ClO)2+2HCl=CaCl2+2HClO.
点评 本题考查含氯化合物的重要应用,为高频考点,侧重于化学与生活的考查,有利于培养学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
5.下列说法正确的是( )
| A. | 卤代烃不是烃 | B. | 含羟基的化合物一定是醇 | ||
| C. | 芳香烃不是烃 | D. | 含醛基的化合物一定是醛 |
9.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是 2,5,5-三甲基-3-乙基庚烷 的名称是 2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将 与NaOH的醇溶液共热可制备 CH3-CH═CH2 与NaOH的醇溶液共热可制备 CH3-CH═CH2 | |
| C. | 向柠檬醛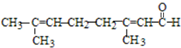 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
16.我国的“神舟五号’,载人飞船己发射成功,“嫦娥”探月工程也己正式启动.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法正确的是( )
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | ||
| C. | ${\;}_{2}^{3}$He原子核内含有3 个中子 | D. | ${\;}_{2}^{4}$He具有较强的金属性 |
14.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 1L 0.1mol/L的AlCl3溶液中含有Al3+离子数为0.1NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在密闭容器中加入1.5mol H2和0.5mol N2充分反应后可得到NH3为1NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
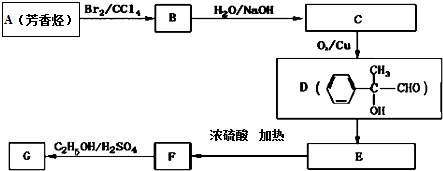
 .
.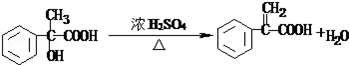 .
.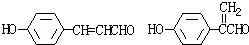 .
.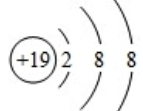 ;
;