题目内容
12.已知反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,(1)氧化剂MnO2,还原剂HCl,
(2)氧化剂与还原剂的物质的量之比1:2,
(3)当生成标况下44.8L Cl2时转移了4mol电子.
(4)用双线桥法表示电子转移情况.
分析 在4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O的反应中,化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,化合价升高元素是Cl元素,所在的反应物HCl是还原剂,化合价升高数=化合价降低数=转移电子数=2,即每生成氯气1mol,就会转移2mol电子,据此分析解答.
解答 解:在4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O的反应中,化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,化合价升高元素是Cl元素,所在的反应物HCl是还原剂,化合价升高数=化合价降低数=转移电子数=2,即每生成氯气1mol,就会转移2mol电子;
(1)根据以上分析,氧化剂是MnO2,还原剂是HCl;故答案为:MnO2;HCl;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,则MnO2为氧化剂,Cl元素的化合价升高,则HCl为还原剂,反应中4molHCl参加反应只有2mol作还原剂,则该反应中氧化剂和还原剂的物质的量之比是1:2,故答案为:1:2;
(3)根据以上分析,每生成氯气1mol,就会转移2mol电子,所以当生成标况下44.8L Cl2时转移了$\frac{44.8L}{22.4L/mol}$×2=4mol,故答案为:4;
(4)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为 ,故答案为:
,故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度判断相关概念以及物质的性质,难度不大,注意相关知识的学习.

练习册系列答案
相关题目
13.2014年我国纪念“世界水日”活动的宣传主题为“加强河湖管理,建设水生态文明”.下列与水相关的叙述正确的是( )
| A. | 加聚反应也可能有水生成 | |
| B. | 水、乙醇、氢氧化钠中都存在羟基 | |
| C. | 水可以参与有些有机反应,有些有机反应也有水生成 | |
| D. | 有水参加的有机化学反应都可以叫做水解反应 |
7.下列叙述正确的是( )
| A. | CH2ClCH2Cl的系统命名是二氯乙烷 | |
| B. | 四氯化碳的电子式是  | |
| C. | 乙烯的最简式是C2H4 | |
| D. | 2,5-二甲基己烷的核磁氢谱中出现三组峰 |
1.下列描述,其因果关系成立的是( )
| A. | 因为NH3的水溶液可以导电,所以NH3是电解质 | |
| B. | 因为O2可以与CO反应生成CO2,所以可以用O2除去CO2中的杂质CO | |
| C. | 因为液态HCl不导电,所以HCl是非电解质 | |
| D. | 因为氢氧化铁胶体具有吸附性,所以常用于净水 |
2.2012年3月15日,CCTV-1在3•15特别行动节目中,曝光了双汇在食品生产中使用“瘦肉精”猪肉,一时间市场哗然.“瘦肉精”又称克伦特罗,其结构简式如图.下列有关“瘦肉精”的说法不正确的是( )
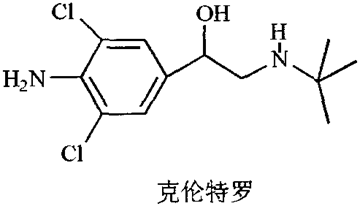

| A. | 它的分子式为C12H18N2Cl2O | |
| B. | 它含有氨基、氯原子等官能团 | |
| C. | 1mol克伦特罗最多能和3 molH2发生加成反应 | |
| D. | 一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等 |
 的系统名称是2,2-二甲基丙烷,它的一氯代物具有不同沸点的产物有1种.
的系统名称是2,2-二甲基丙烷,它的一氯代物具有不同沸点的产物有1种.