题目内容
20.KI、KIO3及KNO3在生产生活中有十分重要的应用.工业上用碘、KOH和铁屑为原料生产碘化钾的流程如图1.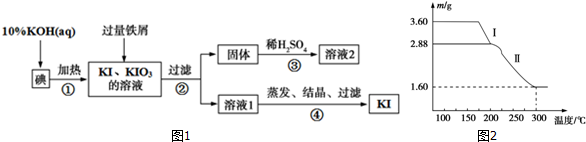
(1)第①步中反应的离子方程式是3I2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5I-+IO3-+3H2O.
(2)第 ②步所得固体中有红褐色物质,溶液2中除H+外,一定含有的阳离子是Fe2+.
(3)溶液2经过一系列转化可得到草酸亚铁晶体(FeC2O4•2H2O,Mr=180),称取3.60g该晶体加热分解,得到剩余固体的质量随温度变化的曲线如图2所示:
过程I发生反应的化学方程式是FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O;若300℃时剩余固体是铁的一种氧化物,其化学式是Fe2O3.
(4)KIO3可作食盐添加剂.工业上常用石墨和铁作电极电解KI溶液制备KIO3,电解时阳极的电极反应式是I--6e-+3H2O=IO3-+6H+.
(5)KNO3是制造黑火药的重要原料.
已知:C(s)+O2(g)=CO2(g)△H1=a kJ/mol
S (s)+2K(s)=K2S(s)△H2=b kJ/mol
2K(s)+N2(g)+3O2(g)=2KNO3(s)△H3=c kJ/mol
黑火药爆炸时,硫磺、硝酸钾与木炭反应生成硫化钾、氮气和二氧化碳的热化学方程式是S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)△H=(3a+b-c)kJ/mol.
分析 由制备流程可知,碘与KOH溶液反应生成KI、KIO3,第 ②步所得固体中有红褐色物质,所以加入过量Fe与KIO3发生氧化还原反应生成KI、氢氧化铁,经过滤后得到固体为氢氧化铁和铁粉,氢氧化铁和铁粉中加硫酸生成溶液2为硫酸亚铁溶液,过滤后溶液1中主要含KI,经蒸发、结晶过滤得到KI;
(1)碘在氢氧化钾溶液中发生自身氧化还原生成IO3-与I-,结合电子、电荷守恒分析;
(2)由溶液含H+,固体完全溶解,Fe与硫酸铁反应生成硫酸亚铁;
(3)过程I使其质量减少3.60-2.88g=0.72g,恰好为0.4mol水的质量;由元素守恒计算氧化物中Fe元素的质量,再利用原子个数比确定化学式;
(4)电解时阳极发生氧化反应,反应中碘离子失电子生成碘酸根离子;
(5)根据盖斯定律,将反应①C(s)+O2(g)=CO2(g)△H1=a kJ/mol;②S (s)+2K(s)=K2S(s)△H2=b kJ/mol;③2K(s)+N2(g)+3O2(g)=2KNO3(s)△H3=c kJ/mol,将①×3+②-③可得硫磺、硝酸钾与木炭反应生成硫化钾、氮气和二氧化碳的热化学方程式.
解答 解:由制备流程可知,碘与KOH溶液反应生成KI、KIO3,第 ②步所得固体中有红褐色物质,所以加入过量Fe与KIO3发生氧化还原反应生成KI、氢氧化铁,经过滤后得到固体为氢氧化铁和铁粉,氢氧化铁和铁粉中加硫酸生成溶液2为硫酸亚铁溶液,过滤后溶液1中主要含KI,经蒸发、结晶过滤得到KI;
(1)碘在氢氧化钾溶液中发生自身氧化还原生成IO3-与I-,反应的离子方程式为3I2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5I-+IO3-+3H2O,
故答案为:3I2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5I-+IO3-+3H2O;
(2)固体中除剩余铁屑外,还有红褐色固体,加硫酸得到溶液2除含有H+外,固体完全溶解,一定含有的阳离子是Fe2+,
故答案为:Fe2+;
(3)3.60g草酸亚铁晶体,物质的量为0.2mol,过程I使其质量减少3.60-2.88g=0.72g,恰好为0.4mol水的质量,则过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,反应的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O,草酸亚铁晶体中的铁元素质量为:3.6g×$\frac{56}{180}$×100%=1.12g,草酸亚铁晶体中的铁元素完全转化到氧化物中,氧化物中氧元素的质量为:1.60g-1.12g=0.48g,铁元素和氧元素的质量比为:1.12g:0.48g=7:3,
设铁的氧化物的化学式为FexOy,
则56x:16y=7:3,
x:y=2:3,
铁的氧化物的化学式为Fe2O3,
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeC2O4+2H2O;Fe2O3;
(4)电解时阳极发生氧化反应,反应中碘离子失电子生成碘酸根离子,电极反应式为I--6e-+3H2O=IO3-+6H+,
故答案为:I--6e-+3H2O=IO3-+6H+;
(5)根据盖斯定律,将反应①C(s)+O2(g)=CO2(g)△H1=a kJ/mol;②S (s)+2K(s)=K2S(s)△H2=b kJ/mol;③2K(s)+N2(g)+3O2(g)=2KNO3(s)△H3=c kJ/mol,将①×3+②-③可得硫磺、硝酸钾与木炭反应生成硫化钾、氮气和二氧化碳的热化学方程式为S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)△H=(3a+b-c) kJ/mol,
故答案为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)△H=(3a+b-c) kJ/mol.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应及氧化还原反应的分析、质量守恒的计算等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

| A. | 过滤、结晶、焰色反应、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| B. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,然后涂上稀硼酸溶液 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 检验淀粉是否发生水解,可在溶液中滴加新制氢氧化铜悬浊液,加热至沸腾,若有红色沉淀生成说明已水解,反之则没有水解 |
| A. | 由苯制溴苯;甲烷、氯气在光照条件下得到一氯甲烷、二氯甲烷等 | |
| B. | 由乙烯制1,2-二溴乙烷:由乙烷制一氯乙烷 | |
| C. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 由苯制硝基苯;由苯制环己烷 |
| A. | 它们所含元素的种类相同,但通式不同 | |
| B. | 均能与水发生加成反应 | |
| C. | 均能与氯气发生反应 | |
| D. | 烯烃分子中的碳原子数≥2,烷烃分子中的碳原子数≥1 |
| A. | 铝不活泼 | B. | 铝表面有致密氧化膜 | ||
| C. | 铝化学性质稳定 |
| A. | 12g 12C的物质的量为2mol | |
| B. | H2的相对分子质量为4 | |
| C. | 1mol水所含的分子数约为3.01×1023 | |
| D. | 56g铁所含的原子数约为6.02×1023 |
| A. | 100mL0.5mol/L MgCl2溶液 | B. | 200mL 0.25mol/L CaCl2溶液 | ||
| C. | 50mL 1.0mol/L NaCl溶液 | D. | 25mL0.4mol/L HCl溶液 |