题目内容
下列说法正确的是( )
| A、在铁片上镀铜时,若阴极增重3.2g,则电镀液中通过的电子的物质的量为0.1mol |
| B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的负极反应不同 |
| C、参加反应的物质的性质是决定化学反应速率的重要因素 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、根据电极反应式结合电子守恒来计算回答;
B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的正极反应不同;
C、影响反应速率的主要因素是物质本身的性质;
D、根据电解池的工作原理以及电解饱和食盐水时,两极上的产物来回答.
B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的正极反应不同;
C、影响反应速率的主要因素是物质本身的性质;
D、根据电解池的工作原理以及电解饱和食盐水时,两极上的产物来回答.
解答:
解:A、在铁片上镀铜时,铁片为阴极,发生反应:Cu2++2e-=Cu,若铁片增重3.2g,即生成金属铜为3.2g,转移电子是0.1mol,但电子不通过电镀液,故A错误;
B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的正极反应不同,故B错误;
C、影响反应速率的主要因素是物质本身的性质,故C正确;
D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极极区产生的Cl2进入阴极区,故D错误;
故选C.
B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的正极反应不同,故B错误;
C、影响反应速率的主要因素是物质本身的性质,故C正确;
D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极极区产生的Cl2进入阴极区,故D错误;
故选C.
点评:本题考查学生电解池的工作原理以及金属的电化学腐蚀和防护知识,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
相关题目
下列有关实验操作的叙述中,合理的是( )
| A、把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
| B、中和滴定前,用待测液润洗锥形瓶 |
| C、将10g CuSO4?5H2O溶解在90g水中配制10%的CuSO4溶液 |
| D、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
下列各组括号内的试剂,能用于除掉物质中杂质的是( )
| A、Fe粉中混有Zn粉杂质(稀H2SO4) |
| B、FeCl2中混有FeCl3杂质(Cl2) |
| C、CO气体中混有CO2杂质(NaOH溶液) |
| D、FeCl3中混有FeCl2杂质(铁屑) |
反应A(g)+2B(g)═C(g)的反应过程中能量变化如图所示.下列相关说法正确的是( )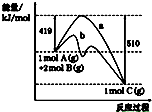

| A、正反应活化能大于逆反应活化能 |
| B、曲线b表示使用催化剂后的能量变化 |
| C、由图可知该反应的焓变△H=+91 kJ?mol-1 |
| D、反应中将气体A换为固体反应,其他条件不变,反应放出热量小于91kJ |
能证明淀粉已经完全水解的试剂是( )
| A、碘化钾溶液 | B、银氨溶液 |
| C、碘水 | D、酚酞试剂 |
短周期元素X、Y、Z三种原子核外电子总数为32,都可形成常温下气体单质.X原子最外层电子数是其内层电子数的3倍;Y的气态氢化物与其最高价氧化物对应的水化物恰好反应的产物只有一种A,A的水溶液显酸性.下列说法正确的是( )
| A、原子半径:Z>X>Y |
| B、X元素形成的单质其摩尔质量一定是32g?moL-1 |
| C、物质A中既含离子键又含共价键 |
| D、YX2、ZX2都有对应的含氧酸 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温下,28g Fe与足量的浓硝酸反应,转移的电子数为1.5 NA |
| B、常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数为0.3NA |
| C、1.0L 1.0 mol/LNaAlO2水溶液中含有的氧原子数为2NA |
| D、11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA |