题目内容
下列有关实验操作的叙述中,合理的是( )
| A、把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
| B、中和滴定前,用待测液润洗锥形瓶 |
| C、将10g CuSO4?5H2O溶解在90g水中配制10%的CuSO4溶液 |
| D、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
考点:化学实验方案的评价
专题:
分析:A.二氧化硫为酸性氧化物,不能漂白紫色石蕊试液;
B.PH试纸湿润后再测定溶液PH会稀释待测溶液;
C.10g CuSO4?5H2O中含有的CuSO4的质量小于10g;
D.定容时俯视容量瓶的刻度线,体积偏小.
B.PH试纸湿润后再测定溶液PH会稀释待测溶液;
C.10g CuSO4?5H2O中含有的CuSO4的质量小于10g;
D.定容时俯视容量瓶的刻度线,体积偏小.
解答:
解:A.二氧化硫为酸性氧化物,不能漂白紫色石蕊试液,则把SO2通入紫色石蕊试液中,溶液为红色,说明二氧化硫为酸性氧化物,故A错误;
B.PH试纸湿润后再测定食醋溶液PH会稀释待测溶液,测定的溶液PH会增大,故B错误;
C.10g CuSO4?5H2O中含有的CuSO4的质量小于10g,质量分数小于10%,故C错误;
D.定容时俯视容量瓶的刻度线,体积偏小,浓度偏高,故D正确.
故选D.
B.PH试纸湿润后再测定食醋溶液PH会稀释待测溶液,测定的溶液PH会增大,故B错误;
C.10g CuSO4?5H2O中含有的CuSO4的质量小于10g,质量分数小于10%,故C错误;
D.定容时俯视容量瓶的刻度线,体积偏小,浓度偏高,故D正确.
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及物质的性质、pH测定、质量分数以及溶液配制等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
如图表示在催化剂作用下将X和Y合成具有生物活性物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述正确的是( )
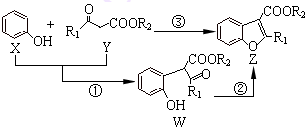

| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |
下列叙述中正确的是( )
| A、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| B、能使润湿的淀粉KI试纸变成蓝色的物质一定是C12 |
| C、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
下列说法正确的是( )
| A、在铁片上镀铜时,若阴极增重3.2g,则电镀液中通过的电子的物质的量为0.1mol |
| B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的负极反应不同 |
| C、参加反应的物质的性质是决定化学反应速率的重要因素 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |