题目内容
 国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.(1)已知25℃时:SO2(g)+2CO(g)═2C02(g)+
| 1 |
| x |
2COS(g)+SO2(g)═2CO2(g)+
| 3 |
| x |
(2)有人设想按如图甲所示装置用废气中的SO2生产硫酸.写出SO2电极的电极反应式
(3)提高反应2SO2(g)+O2?2SO3(g)△H<0中SO2的转化率是控制SO2排放的关键措施之一.某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为
50%,前5min内SO2的平均反应速率为
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是
a温度和容器体积不变,充入1.0molHe (g)
b温度和容器体积不变,充入2molSO2和lmolO2
c温度和容器体积不变,充入1.0molSO2
d在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)?2SO3(g)反应的影响,实验结果如
图乙所示.(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的
是
考点:热化学方程式,常见化学电源的种类及其工作原理,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)根据原电池反应是氧化还原反应,负极失电子发生氧化反应,正极上得到电子发生还原反应;
(3)①依据化学平衡三段式列式计算;
②改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大,依据化学平衡影响因素和平衡移动原理分析判断;
③依据图象分析,随压强量的增加,二氧化硫的转化率增大;依据平衡移动原理,反应是放热反应,温度越高,平衡逆向进行,三氧化硫含量减小.
(2)根据原电池反应是氧化还原反应,负极失电子发生氧化反应,正极上得到电子发生还原反应;
(3)①依据化学平衡三段式列式计算;
②改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大,依据化学平衡影响因素和平衡移动原理分析判断;
③依据图象分析,随压强量的增加,二氧化硫的转化率增大;依据平衡移动原理,反应是放热反应,温度越高,平衡逆向进行,三氧化硫含量减小.
解答:
解:(1)①SO2(g)+2CO(g)═2C02(g)+
Sx(s)△H=a kJ?mol-1;
②2COS(g)+SO2(g)═2CO2(g)+
Sx(s)△H=b kJ?mol-1.
依据盖斯定律(①×2-②)÷2得到:CO(g)+
Sx(s)=COS(g)△H=
KJ/mol,
故答案为:CO(g)+
Sx(s)=COS(g)△H=
KJ/mol;
(2)据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;电极反应为:SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(3)①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,
2SO2(g)+O2?2SO3(g)△H<0
起始量(mol) 4.0 2.0 0
变化量(mol)4.0×50% 1.0 2.0
平衡量(mol) 2.0 1.0 2.0
前5min内SO2的平均反应速率=
=0.2mol/L?min;
故答案为:0.2mol/L?min;
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是:
a、温度和容器体积不变,充入1.0molHe (g),总压增大,分压不变,平衡不动,故a不符合;
b、温度和容器体积不变,充入2molSO2和lmolO2,相当于增大压强,平衡正向进行,SO2的转化率及SO3的平衡浓度都比原来增大,故b符合;
c、温度和容器体积不变,充入1.0molSO2 ,平衡正向进行,三氧化硫浓度增大,二氧化硫转化率减小,故c不符合;
d、在其他条件不变时,减小容器的容积,压强增大,平衡正向进行,SO2的转化率及SO3的平衡浓度都比原来增大,故d符合;
故答案为:bd;
③依据图象分析,随压强量的增加,二氧化硫的转化率增大;依据平衡移动原理,反应是放热反应,温度越高,平衡逆向进行,三氧化硫含量减小,所以T1>T2,
故答案为:c;>.
| 1 |
| x |
②2COS(g)+SO2(g)═2CO2(g)+
| 3 |
| x |
依据盖斯定律(①×2-②)÷2得到:CO(g)+
| 1 |
| x |
| a-b |
| 2 |
故答案为:CO(g)+
| 1 |
| x |
| a-b |
| 2 |
(2)据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;电极反应为:SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(3)①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,
2SO2(g)+O2?2SO3(g)△H<0
起始量(mol) 4.0 2.0 0
变化量(mol)4.0×50% 1.0 2.0
平衡量(mol) 2.0 1.0 2.0
前5min内SO2的平均反应速率=
| ||
| 5min |
故答案为:0.2mol/L?min;
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是:
a、温度和容器体积不变,充入1.0molHe (g),总压增大,分压不变,平衡不动,故a不符合;
b、温度和容器体积不变,充入2molSO2和lmolO2,相当于增大压强,平衡正向进行,SO2的转化率及SO3的平衡浓度都比原来增大,故b符合;
c、温度和容器体积不变,充入1.0molSO2 ,平衡正向进行,三氧化硫浓度增大,二氧化硫转化率减小,故c不符合;
d、在其他条件不变时,减小容器的容积,压强增大,平衡正向进行,SO2的转化率及SO3的平衡浓度都比原来增大,故d符合;
故答案为:bd;
③依据图象分析,随压强量的增加,二氧化硫的转化率增大;依据平衡移动原理,反应是放热反应,温度越高,平衡逆向进行,三氧化硫含量减小,所以T1>T2,
故答案为:c;>.
点评:本题考查了化学平衡的有关知识,化学反应进行的方向判断,转化率的计算、外界条件对化学平衡的影响,图象分析是关键,题目难度中等.

练习册系列答案
相关题目
 向绝热恒容密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g)═SO3(g)+NO(g),其正反应速率(v)随时间(t)变化的关系如图所示.下列结论中错误的是( )
向绝热恒容密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g)═SO3(g)+NO(g),其正反应速率(v)随时间(t)变化的关系如图所示.下列结论中错误的是( )| A、反应在c点达到平衡状态 |
| B、反应物的浓度:a点大于b点 |
| C、反应物的总能量高于生成物的总能量 |
| D、逆反应速率:c点大于b点 |
2011年被联合国大会确定为“国际化学年”.以“化学--我们的生活,我们的未来”为主题庆祝化学对人类文明作出的重要贡献.下列叙述与化学变化无直接关系的是( )
| A、使用防腐剂延长食品保质期 |
| B、利用风力发电,获取清洁能源 |
| C、研发可降解塑料,控制白色污染 |
| D、将汽车尾气中的NO和CO转化为无害气体 |
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为36,原子最外层电子数之和为14.其中A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.下列叙述正确的是( )
| A、一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
| B、D元素处于元素周期表中第3周期第IVA族 |
| C、A、C的最高价氧化物均为离子化合物 |
| D、四种元素的原子半径:A>B>D>C |
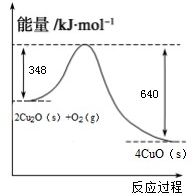 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.