题目内容
 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.(1)火法还原CuO可制得Cu2O.已知:
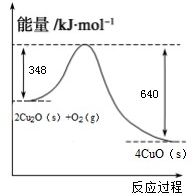
1g C(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如右图所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O.该反应的化学方程式为
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响.
①在体积均为1L,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,发生反应:2H2O(g)
| ||
| Cu2O |
经测定A、B两容器在反应过程中发生如图1所示变化,则A、B两容器反应的温度T1
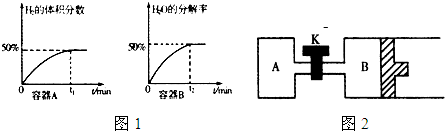
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是
A.向平衡混合物中充入Ar B.升高反应的温度 C.增大反应体系的压强 D.向平衡混合物中充人O2
③如图2所示,当关闭K时,向容器A、B中分别充入0.2mol H2O(g)向B中充入0.2mol H2O(g),起始时V(A)=V(B)=1L.在相同温度(反应过程中温度保持不变,B中活塞可以自由滑动)和催化剂存在的条件下,达到平衡时,V(B)=1.2L.请回答:
A中H2O(g)的分解率
考点:化学平衡的影响因素,热化学方程式
专题:化学反应中的能量变化,化学平衡专题
分析:(1)分析图象结合热化学方程式和盖斯定律解答.
(2)液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O,根据原子守恒配平书写化学方程式,根据电子转移数目守恒计算;
(3)①依据化学方程式结合图象中t1中氢气含量计算分析;
②既能增大反应速率,又能增大H2O(g)分解率的条件为升温,减压,依据平衡移动原理分析判断;
③A为恒温恒容容器,B为恒温恒压容器,随反应进行A容器中压强增大,B容器中为维持恒压,体积增大,平衡正向进行,所以A容器中水的分解率小于B中容器中水的分解率,打开K,过一段时间重新达平衡时,为恒压容器,物质的量之比等于体积之比,平衡后体积为2.4L;
(2)液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O,根据原子守恒配平书写化学方程式,根据电子转移数目守恒计算;
(3)①依据化学方程式结合图象中t1中氢气含量计算分析;
②既能增大反应速率,又能增大H2O(g)分解率的条件为升温,减压,依据平衡移动原理分析判断;
③A为恒温恒容容器,B为恒温恒压容器,随反应进行A容器中压强增大,B容器中为维持恒压,体积增大,平衡正向进行,所以A容器中水的分解率小于B中容器中水的分解率,打开K,过一段时间重新达平衡时,为恒压容器,物质的量之比等于体积之比,平衡后体积为2.4L;
解答:
解:(1)已知:1g C(s)燃烧全部生成CO时放出热量9.2kJ;24gC燃烧生成一氧化碳放热220.8KJ,热化学方程式为:2C(s)+O2(g)=2CO(g)△H=-220.8kJ?mol-1,依据图象书写热化学方程式2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ?mol-1;
①2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ?mol-1
②2C(s)+O2(g)=2CO(g)△H=-220.8kJ?mol-1
根据盖斯定律,②-①得4CuO(s)+2C(s)=2CO(g)+2Cu2O(s),△H=+71kJ?mol-1
即2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.6kJ?mol-1
故答案为:2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.6kJ?mol-1.
(2)用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O,反应的化学方程式为:4Cu(OH)2+N2H4=2Cu2O+N2+6H2O,令生成的Cu2O的物质的量为nmol,根据电子转移数目守恒,则有
nmol×2×(1-0)=
×2×[0-(-2)],解得n=1mol;
所以可制备Cu2O的质量为1mol×144g/mol=144g.
故答案为:4Cu(OH)2+N2H4=2Cu2O+N2+6H2O,144g;
(3)①依据化学方程式计算;依据图象中氢气百分含量为50%,设反应的水的物质的量为x
2H2O(g)
2H2(g)+O2 △H=484kJ?mol-1
2mol 484KJ
x x 0.5x
=50%,
计算得到x=
mol;反应放热=
=16.1KJ;
水的分解率=
×100%=66,7%,和T2温度下水的分解率为50%,反应是吸热反应,温度越高水的分解率越大;所以T1>T2;
故答案为:>,16.1;
②既能增大反应速率,又能增大H2O(g)分解率的条件为升温,减压,依据平衡移动原理分析判断;
A.向平衡混合物中充入Ar,增大体系压强,平衡逆向进行,故A不符合;
B.反应是吸热反应,升高反应的温度,反应速率增大,平衡正向进行,水的分解率增大,故B符合;
C.反应是气体体积增大的反应,增大反应体系的压强,平衡逆向进行,故C不符合;
D.向平衡混合物中充人O2,平衡逆向进行,故D不符合;
故答案为:B;
③A为恒温恒容容器,B为恒温恒压容器,随反应进行A容器中压强增大,B容器中为维持恒压,体积增大,平衡正向进行,所以A容器中水的分解率小于B中容器中水的分解率,打开K,过一段时间重新达平衡时,为恒压容器,物质的量之比等于体积之比,平衡后体积为2.4L,B的体积为2.4L-1L=1.4L;
故答案为:<,1.4;
①2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ?mol-1
②2C(s)+O2(g)=2CO(g)△H=-220.8kJ?mol-1
根据盖斯定律,②-①得4CuO(s)+2C(s)=2CO(g)+2Cu2O(s),△H=+71kJ?mol-1
即2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.6kJ?mol-1
故答案为:2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.6kJ?mol-1.
(2)用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O,反应的化学方程式为:4Cu(OH)2+N2H4=2Cu2O+N2+6H2O,令生成的Cu2O的物质的量为nmol,根据电子转移数目守恒,则有
nmol×2×(1-0)=
| 11.2L |
| 22.4L/mol |
所以可制备Cu2O的质量为1mol×144g/mol=144g.
故答案为:4Cu(OH)2+N2H4=2Cu2O+N2+6H2O,144g;
(3)①依据化学方程式计算;依据图象中氢气百分含量为50%,设反应的水的物质的量为x
2H2O(g)
| ||
| Cu2O |
2mol 484KJ
x x 0.5x
| x |
| 0.1mol-x+x+0.5x |
计算得到x=
| 1 |
| 15 |
| ||
| 2 |
水的分解率=
| ||
| 0.1 |
故答案为:>,16.1;
②既能增大反应速率,又能增大H2O(g)分解率的条件为升温,减压,依据平衡移动原理分析判断;
A.向平衡混合物中充入Ar,增大体系压强,平衡逆向进行,故A不符合;
B.反应是吸热反应,升高反应的温度,反应速率增大,平衡正向进行,水的分解率增大,故B符合;
C.反应是气体体积增大的反应,增大反应体系的压强,平衡逆向进行,故C不符合;
D.向平衡混合物中充人O2,平衡逆向进行,故D不符合;
故答案为:B;
③A为恒温恒容容器,B为恒温恒压容器,随反应进行A容器中压强增大,B容器中为维持恒压,体积增大,平衡正向进行,所以A容器中水的分解率小于B中容器中水的分解率,打开K,过一段时间重新达平衡时,为恒压容器,物质的量之比等于体积之比,平衡后体积为2.4L,B的体积为2.4L-1L=1.4L;
故答案为:<,1.4;
点评:本题考查了热化学方程式的书写方法和盖斯定律的计算应用,化学平衡影响因素分析判断,注意平衡建立的条件分析应用,题目难度中等.

练习册系列答案
相关题目
 科学家哈迈德?译维尔研究运用激光技术观察化学反应时分子中原子的运动,在研究中证实光可诱发如图所示的变化.下列叙述不正确的是( )
科学家哈迈德?译维尔研究运用激光技术观察化学反应时分子中原子的运动,在研究中证实光可诱发如图所示的变化.下列叙述不正确的是( )| A、两物质的分子式相同 |
| B、两物质均可发生加成反应 |
| C、两物质分子中所有原子不可能处于同一平面上 |
| D、它们都属于芳香烃衍生物 |
下列离子方程式正确的是( )
A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO
| ||
| B、BaCO3和盐酸:BaCO3+2H+=Ba2++CO2↑+H2O | ||
| C、铜与盐酸反应:Cu+2H+=Cu2++H2↑ | ||
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ |
下列关于放射性气体氡
Rn的说法正确的是( )
222 86 |
| A、质量数为222 |
| B、中子数为86 |
| C、质子数为136 |
| D、核电荷数为222 |
 国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
