题目内容
1.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,d极发生氧化反应,则四种金属活动性顺序由强到弱正确的是( )| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
分析 原电池中,活泼性较强的电极为负极,活泼性较弱的电极为正极,放电时,电流从正极沿导线流向负极,正极上得电子发生还原反应,据此分析解答.
解答 解:原电池中,活泼性较强的电极为负极,活泼性较弱的电极为正极,放电时,电流从正极沿导线流向负极,正极上得电子发生还原反应,a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极,则活泼性a>b;
c、d相连时,电流由d到c,则活泼性c>d;
a、c相连时,c极上产生大量气泡,则活泼性a>c;
b、d相连时,d极发生氧化反应,则活泼性d>b,
通过以上分析知,金属活泼性强弱顺序是a>c>d>b,
故选:B.
点评 本题以原电池原理为载体考查金属活泼性强弱判断,明确原电池正负极与金属活泼性的关系是解本题关键,再结合正负极的判断方法分析解答,题目难度不大.

练习册系列答案
相关题目
6.菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷(As),西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法正确的是( )
| A. | 因为河虾中含有砷元素,所以不能食用 | |
| B. | “两者同食”发生的反应中维生素C作氧化剂 | |
| C. | 五价砷在维生素C作用下发生了还原反应 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5 |
7.第ⅡA族元素具有相似的化学性质,是由于它们的原子具有相同的( )
| A. | 原子半径 | B. | 电子层数 | C. | 核外电子数 | D. | 最外层电子数 |
4.下列对化学知识概括合理的是( )
| A. | 酸性氧化物都是非金属氧化物 | |
| B. | 乙醇和二甲醚分子式相同,结构不同,互为同素异形体 | |
| C. | 丁达尔效应可用于区别溶液与胶体 | |
| D. | 熔融状态能导电的物质一定是离子化合物 |
11.将按等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,再滴入含有品红和Ba(NO3)2的混合溶液,则发生的实验现象是( )
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
13.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
10.下列关于胶体的说法中,正确的是( )
| A. | 胶体一定是均一、透明、介稳的 | B. | 用丁达尔效应区别胶体和溶液 | ||
| C. | 可以用滤纸来分离胶体和溶液 | D. | 胶体只能在液体中形成 |
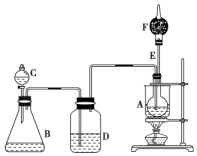 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图. .
.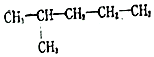 2-甲基戊烷
2-甲基戊烷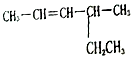 4-甲基-2-己烯.
4-甲基-2-己烯.