题目内容
室温下,用0.1 mol·Lˉ 1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
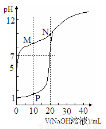
A.HX为弱酸
B.M点c(HX)-c(X-)﹥c(OH-)-c(H+)
C.将P点和N点的溶液混合,呈酸性
D.向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX) = c(Cl-) ﹥c(X-)
练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
9.下列有机物命名正确的是( )
| A. |  2-甲基-2-氯丙烷 | B. |  2-甲基-1-丙醇 | C. |  1,3,4-三甲苯 | D. |  2-甲基-3-丁炔 |
10. 已知短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素.常温下X、Z,W均可与Y反应,A、C、D的原子序数及0.1 mol/LX、Z、W溶液的pH如图所示.下列说法正确的是( )
已知短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素.常温下X、Z,W均可与Y反应,A、C、D的原子序数及0.1 mol/LX、Z、W溶液的pH如图所示.下列说法正确的是( )
 已知短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素.常温下X、Z,W均可与Y反应,A、C、D的原子序数及0.1 mol/LX、Z、W溶液的pH如图所示.下列说法正确的是( )
已知短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素.常温下X、Z,W均可与Y反应,A、C、D的原子序数及0.1 mol/LX、Z、W溶液的pH如图所示.下列说法正确的是( )| A. | B和D形成的化合物和W具有相同的化学键类型与晶体类型 | |
| B. | C氢化物稳定性大于D氢化物稳定性,而其水溶液的酸性D大于C | |
| C. | B与C所形成的化合物既可以由B、C的单质相互反应制得,也可由含B、C元素简单离子的盐溶液相互反应制得 | |
| D. | A、B、C、D四种元素均在第三周期,而其原子半径依次增大,对应简单离子的半径依次减小 |
25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)电解质由强至弱顺序为_________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶 液
液 中结合H+的能力由大到小的顺序为_____________。
中结合H+的能力由大到小的顺序为_____________。
(4)NaHSO3溶液显酸性的原因___________________________(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是_______________.
2.下列有关反应限度的叙述正确的是( )
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 当可逆反应达到反应限度时,反应会自动停止 | |
| C. | 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中加少量KCl固体,则溶液颜色变深 |


 B.H2O:0.002mol•L﹣1
B.H2O:0.002mol•L﹣1 CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) O2)•c(Cu)]/[c(CO)•c(CuO)]
O2)•c(Cu)]/[c(CO)•c(CuO)]