题目内容
15.下列说法或表示方法正确的是( )| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含5mol H2SO4的浓硫酸与含1mol NaOH的稀溶液混合,放出的热量大于57.3kJ | |
| C. | 由C(石墨)=C(金刚石)△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1 |
分析 A.硫蒸气比硫固体的能量高;
B.浓硫酸稀释放热;
C.石墨的能量低;
D.2g H2物质的量为1mol,完全燃烧生成液态水,放出285.8kJ热量.
解答 解:A.固体硫转化为气态硫需要吸热,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,故A错误;
B.若将含5mol H2SO4的浓硫酸与含1mol NaOH的稀溶液混合,浓硫酸溶解过程放热,所以反应放出的热量大于57.3kJ,故B正确;
C.由C(石墨)=C(金刚石)△H=+1.90kJ•mol-1可知,反应是吸热反应,金刚石能量高于石墨,金刚石比石墨活泼,故C错误;
D.在101kPa时,2g H2物质的量为1mol,完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、热化学反应方程式书写为解答的关键,侧重分析与应用能力的考查,注意燃烧热的判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列说法中正确的是( )


| A. | 酸碱中和反应是放热反应 | |
| B. | 图1所示的反应为吸热反应 | |
| C. | 图2装置中铜片是负极,锌片表面有气泡出现 | |
| D. | 图2装置是将电能转变为化学能的装置 |
10.碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
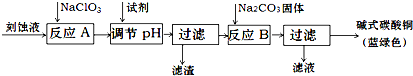
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3(写化学式).
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(2)调节反应A后溶液的pH范围应为3.2-4.2.可以选择的试剂是d(填序号).
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是CuO .(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净,其它合理答案也给分.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
③若生成Cu(OH)2和CuCO3的混合物(即碱式盐).则说明碳酸铜于氢氧化铜的溶解度相近
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成.步骤如下:
①称量样品;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO.
请对上述测定方案作出评价.①称量样品的质量必须知道,③测出CO2的质量④测出水蒸汽的质量⑤称量CuO的质量三个数据知道其中的任意两个即可,另一部分的数据可由样品的质量和已知两部分的质量求得..
20.化学反应中通常伴随着能量变化,下列说法中错误的是( )
| A. | 煤燃烧时并不能将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池放电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
7.处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S和无毒的气体.已知:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0kJ•mol-1
下列说法正确的是( )
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②S(g)+O2(g)=SO2(g)△H=-296.0kJ•mol-1
下列说法正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 反应②△H<0,所以该反应能自发进行 | |
| C. | 使用催化剂能提高其转化率 | |
| D. | 根据①和②推知总反应为2CO(g)+SO2(g)=S(s)+2CO2 (g)△H=-270kJ•mol-1 |
4.能正确表示下列化学反应的离子方程式的是( )
| A. | 澄清的石灰水与稀硝酸反应:OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸的反应:OH${\;}^{{-}^{\;}}$+H+═H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸溶液与碳酸钙反应:CaCO3+2H+═Ca2++CO2↑+H2O |
5.将6.4gSO2和8.0gSO3相比较,下列结论中错误的是( )
| A. | 它们所含氧原子数目之比为2:3 | B. | 它们的体积之比为1:1 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的分子数目之比为1:1 |