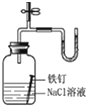
题目内容
下列各组物质相互反应后,最终没有白色沉淀生成的是( )
| A、过量Ba( OH)2溶液加入明矾溶液 |
| B、过氧化钠投入到FeC12溶液中 |
| C、向NaAlO2溶液中通入过量CO2 |
| D、向饱和Na2CO3溶液中通入过量CO2 |
考点:钠的重要化合物
专题:
分析:A.过量Ba( OH)2溶液加入明矾溶液,可生成硫酸钡沉淀;
B.过氧化钠投入到FeC12溶液中生成氢氧化铁沉淀;
C.向NaAlO2溶液中通入过量CO2,生成氢氧化铝沉淀;
D.向饱和Na2CO3溶液中通入过量CO2生成碳酸氢钠.
B.过氧化钠投入到FeC12溶液中生成氢氧化铁沉淀;
C.向NaAlO2溶液中通入过量CO2,生成氢氧化铝沉淀;
D.向饱和Na2CO3溶液中通入过量CO2生成碳酸氢钠.
解答:
解:A.过量Ba(OH)2溶液和明矾溶液混合Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,最终只有白色硫酸钡沉淀,故A不选;
B.过氧化钠投入到FeC12溶液中生成氢氧化铁沉淀,为红棕色沉淀,故B选;
C.向NaAlO2溶液中通入过量的CO2,二氧化碳过量,偏铝酸钠溶液与二氧化碳反应生成了氢氧化铝和碳酸氢钠,沉淀不溶解,故C不选;
D.向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以产生白色沉淀,故D不选.
故选B.
B.过氧化钠投入到FeC12溶液中生成氢氧化铁沉淀,为红棕色沉淀,故B选;
C.向NaAlO2溶液中通入过量的CO2,二氧化碳过量,偏铝酸钠溶液与二氧化碳反应生成了氢氧化铝和碳酸氢钠,沉淀不溶解,故C不选;
D.向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以产生白色沉淀,故D不选.
故选B.
点评:本题考查综合考查元素化合物知识,为高考常见题型,侧重于物质性质的分析应用,主要是试剂量不同产物本题的产物判断,反应现象的分析应用,注意相关基础知识的积累,题目难度中等.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
 在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )
在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )| A、△H<0,△S>0 |
| B、△H>0,△S<0 |
| C、△H>0,△S>0 |
| D、△<0,△S<0 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol.实验测得起始、平衡时的有关数据如下表,下列叙述正确的是( )


| A、放出热量关系:a<b<196 |
| B、三个容器内反应的平衡常数:③>①>② |
| C、达平衡时SO3的体积分数:③>① |
| D、SO2的转化率:②>①>③ |
下列关于0.10mol/L NaHCO3溶液的说法正确的是( )
| A、溶质的电离方程式为NaHCO3→Na++H++CO32- |
| B、25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C、离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、温度升高,c(HCO3-)增大 |
下列关于0.1mol?L-1 NH4Cl溶液的说法正确的是( )
| A、向溶液中加滴加几滴浓盐酸,c(NH4+)减少 |
| B、向溶液中加入少量CH3COONa固体,c(NH4+)减少 |
| C、溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、向溶液中加适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )