题目内容
 在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )
在一定条件下,对于反应mA(g)+n(B)?cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的△H、△S判断正确的是( )| A、△H<0,△S>0 |
| B、△H>0,△S<0 |
| C、△H>0,△S>0 |
| D、△<0,△S<0 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:采取定一议二法分析:由图象可知,压强一定时,温度越高C物质的体积分数(C%)越小,说明升高温度平衡向逆反应移动,正反应为放热反应;温度一定时,压强越高C物质的体积分数(C%)越小,说明增大压强平衡向逆反应移动,正反应为体积增大的反应,据此进行判断.
解答:
解:根据图可知:压强一定时,随着温度升高C物质的体积分数(C%)逐渐减小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即:△H<0;
温度一定时,压强越大,C物质的体积分数(C%)越小,增大压强平衡向逆反应移动,增大压强平衡向体积减小的方向移动,即m+n<c+d,所以正方向为气体物质的量增大的方向,则正方向为熵增加的方向,即:△S>0,
所以该反应的△H、△S为:△H<0,△S>0,
故选:A.
温度一定时,压强越大,C物质的体积分数(C%)越小,增大压强平衡向逆反应移动,增大压强平衡向体积减小的方向移动,即m+n<c+d,所以正方向为气体物质的量增大的方向,则正方向为熵增加的方向,即:△S>0,
所以该反应的△H、△S为:△H<0,△S>0,
故选:A.
点评:本题考查了化学平衡图象、外界条件对平衡平衡的影响等知识,题目难度中等,根据气体物质的量的变化分析熵变、根据图象采取定一议二法分析改变条件平衡的移动是关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
下列有实验装置的说法,正确的是( )
A、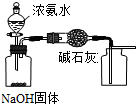 用装置制取干燥纯净的NH3 |
B、 用装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置可证明非金属性Cl>C>Si |
D、 装置向左推动针筒活塞可检验该装置的气密性 |
一定温度下,在体积为10L的密闭容器中充满NH3,进行如下反应:2NH3(g)?3H2(g)+N2(g);经5s达到平衡,平衡时NH3和H2的浓度均为bmol/L.下列叙述中不正确的是( )
A、NH3在5s内的平均速度为
| ||
| B、达到平衡时NH3的分解率为40% | ||
C、N2的平衡浓度为
| ||
| D、反应开始时与平衡时的压强比为5:7 |
化学知识在生产和生活中有着重要的应用.下列说法中,错误的是( )
| A、家中发生天然气泄漏,不能在室内用电话报警 |
| B、洁厕剂和漂白精不能混合使用,否则易产生有毒气体 |
| C、双氧水可用于杀菌、消毒、漂白 |
| D、明矾既可用于净水,又可杀菌消毒 |
下列各组物质相互反应后,最终没有白色沉淀生成的是( )
| A、过量Ba( OH)2溶液加入明矾溶液 |
| B、过氧化钠投入到FeC12溶液中 |
| C、向NaAlO2溶液中通入过量CO2 |
| D、向饱和Na2CO3溶液中通入过量CO2 |



 ,除生成
,除生成 外,另一种产物是
外,另一种产物是
