题目内容
Ⅰ.在体积为2L的密闭容器中,充入lmol CO2和2.6mol H2,一定条件下发生反应:
CO2 (g)+3H2 (g)?CH3OH(g)+H2O(g);△H=-49.0kJ?mol-1
测得CO2和CH3OH (g)的浓度随时间变化如图甲所示:
(1)从反应开始到第10min,氢气的平均反应速率:v(H2)= ,在这段时间内,反应放出的
热量为 .
(2)在该条件下,反应的平衡常数K= ;如果在某一时刻保持温度不变,只改变浓度,使
c(CO2)=1.00mol?L -1,c(H2)=2.00mol?L -1,c(CH3OH)=c(H2O)=0.80mol?L -1,
则平衡 (填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使
增大的是 (填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O (g)从体系中分离 d.再充入l mol CH3OH (g)
Ⅱ.在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中(如图乙),活塞的一
端与大气相通容器中发生如下反应:
N2(g)+3H2(g)?2NH3(g);△H<0
反应达到平衡后,测得混合气体为7体积.
请据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同.
①a═1,c═2,则b═ .在此情况下,反应起始时将向反应方向 (填“正”或“逆”)进行.
②若需规定起始时反应向逆方向进行,则c的取值范围是 .
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 .
CO2 (g)+3H2 (g)?CH3OH(g)+H2O(g);△H=-49.0kJ?mol-1
测得CO2和CH3OH (g)的浓度随时间变化如图甲所示:

(1)从反应开始到第10min,氢气的平均反应速率:v(H2)=
热量为
(2)在该条件下,反应的平衡常数K=
c(CO2)=1.00mol?L -1,c(H2)=2.00mol?L -1,c(CH3OH)=c(H2O)=0.80mol?L -1,
则平衡
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使
| n(CH3OH) |
| n(CO2) |
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O (g)从体系中分离 d.再充入l mol CH3OH (g)
Ⅱ.在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中(如图乙),活塞的一
端与大气相通容器中发生如下反应:
N2(g)+3H2(g)?2NH3(g);△H<0
反应达到平衡后,测得混合气体为7体积.
请据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同.
①a═1,c═2,则b═
②若需规定起始时反应向逆方向进行,则c的取值范围是
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是
考点:化学平衡的影响因素
专题:化学平衡专题
分析:Ⅰ(1)反应速率是单位时间内浓度的变化量,根据图求出第10min时二氧化碳的变化量,然后根据热化学方程式求解;
(2)用三行式来求平衡时,各组分的浓度,然后代入平衡常数表达式求解,比较浓度商和平衡常数的相对大小,来判断平衡的移动方向;
(3)外界条件的改变,导致平衡的移动,从而来确定,比值的变化情况;
Ⅱ(1)在定温、定压下进行,要使平衡状态与原平衡状态等效的考查;
(2)①采用极限分析法;②改变外界条件,导致平衡的移动.
(2)用三行式来求平衡时,各组分的浓度,然后代入平衡常数表达式求解,比较浓度商和平衡常数的相对大小,来判断平衡的移动方向;
(3)外界条件的改变,导致平衡的移动,从而来确定,比值的变化情况;
Ⅱ(1)在定温、定压下进行,要使平衡状态与原平衡状态等效的考查;
(2)①采用极限分析法;②改变外界条件,导致平衡的移动.
解答:
解:Ⅰ(1)由图可知从开始到第10min,△C(CO2)=
mol/L=0.1mol/L,所以v(CO2)=
=0.01mol?L-1?min-1,而速率之比等于对应物质的化学计量数之比,则v(H2):v(CO2)=3:1,即v(H2)=3v(CO2)=0.03mol?L-1?min-1 ,由热化学方程式可知消耗1mol的二氧化碳气体,放出49kJ的热量,而从开始到第10min,二氧化碳的变化量为0.2mol,则放出的热量为0.2mol×49kJ/mol=9.8kJ,
故答案为;0.03mol?L-1?min-1;9.8kJ;
(2)由方程式可知 CO2 (g)+3H2 (g)?CH3OH(g)+H2O(g)
初起(mol/l) 0.5 1.3 0 0
变化(mol/l) 0.1 0.3 0.1 0.1
平衡(mol/l) 0.4 1.0 0.1 0.1
所以平衡常数为K=
=0.025
如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol?L -1,c(H2)=2.00mol?L -1,c(CH3OH)=c(H2O)=0.80mol?L -1,
Qc=
=0.08>0.025=K,所以平衡逆向移动,
故答案为:0.025;b;
(3)a、升高温度,平衡逆向移动,
的值减小,故a不选;
b、充入He(g),使体系压强增大,平衡不移动,故比值不变,故b不选;
c、将H2O (g)从体系中分离,平衡正向移动,比值变大,故选c;
d、再充入l mol CH3OH,平衡虽然逆向移动,只是减弱,而不是抵消,仍然以分子增加为主,故选d;
故答案为:cd;
Ⅱ(1)①反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同,恒温恒压条件下,采用极限分析法,c体积的氨气完全转化为氮气和氧气之比是1:3,所以只要a:b=2:6,则b=3a=3,因反应前混合气体为8体积,反应后混合气体为7体积,体积差为1体积,由差量法可解出平衡时氨气为1体积;而在起始时,氨气的体积为c=2体积,比平衡状态时大,为达到同一平衡状态,氨的体积必须减小,所以平衡逆向移动.故答案为:3,逆;
②若需让反应逆向进行,由上述①所求出的平衡时氨气的体积为1可知,氨气的体积必须大于1,最大值则为2体积氮气和6体积氢气完全反应时产生的氨气的体积,即为4体积,则1<c≤4,故答案为:1<c≤4;
(2)由6.5<7可知,上述平衡应向体积缩小的方向移动,即向放热方向移动,所以采取降温措施.故答案为:降低温度、降低温度平衡向正反应方向移动,气体总分子数减少.
| 1-0.8 |
| 2 |
| 0.1mol/L |
| 10min |
故答案为;0.03mol?L-1?min-1;9.8kJ;
(2)由方程式可知 CO2 (g)+3H2 (g)?CH3OH(g)+H2O(g)
初起(mol/l) 0.5 1.3 0 0
变化(mol/l) 0.1 0.3 0.1 0.1
平衡(mol/l) 0.4 1.0 0.1 0.1
所以平衡常数为K=
| 0.1×0.1 |
| 0.4×13 |
如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol?L -1,c(H2)=2.00mol?L -1,c(CH3OH)=c(H2O)=0.80mol?L -1,
Qc=
| 0.8×0.8 |
| 1×23 |
故答案为:0.025;b;
(3)a、升高温度,平衡逆向移动,
| n(CH3OH) |
| n(CO2) |
b、充入He(g),使体系压强增大,平衡不移动,故比值不变,故b不选;
c、将H2O (g)从体系中分离,平衡正向移动,比值变大,故选c;
d、再充入l mol CH3OH,平衡虽然逆向移动,只是减弱,而不是抵消,仍然以分子增加为主,故选d;
故答案为:cd;
Ⅱ(1)①反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同,恒温恒压条件下,采用极限分析法,c体积的氨气完全转化为氮气和氧气之比是1:3,所以只要a:b=2:6,则b=3a=3,因反应前混合气体为8体积,反应后混合气体为7体积,体积差为1体积,由差量法可解出平衡时氨气为1体积;而在起始时,氨气的体积为c=2体积,比平衡状态时大,为达到同一平衡状态,氨的体积必须减小,所以平衡逆向移动.故答案为:3,逆;
②若需让反应逆向进行,由上述①所求出的平衡时氨气的体积为1可知,氨气的体积必须大于1,最大值则为2体积氮气和6体积氢气完全反应时产生的氨气的体积,即为4体积,则1<c≤4,故答案为:1<c≤4;
(2)由6.5<7可知,上述平衡应向体积缩小的方向移动,即向放热方向移动,所以采取降温措施.故答案为:降低温度、降低温度平衡向正反应方向移动,气体总分子数减少.
点评:抓住判断等效平衡的判断方法,一般是将物质全部靠到一边进行极限转化,也就是极端转化的原理,再与原反应进行比较来判断.

练习册系列答案
相关题目
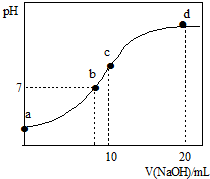 常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、标准状况下,4.48L N2所含的共用电子对数0.2NA |
| D、常温下,1L 0.1mol?L-1的CH3COOH溶液中含有的H+数目为0.1NA |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解.下列说法中不正确的是( )
| A、当阴极产物为铜时,阳极产物一定为氯气 |
| B、当阳极产物为氯气时,阴极上一定会析出铜 |
| C、整个过程中阳极先产生氯气,后产生氧气 |
| D、电解到最后阶段,溶液中的溶质为硫酸钠和硫酸 |
实验是研究化学的基础,如图中所示的实验方法、装置或操作完全正确的是( )
A、 除去Cl2中的HCl |
B、 稀释浓H2SO4 |
C、 制取氨气 |
D、 称取NaOH 称取NaOH |
