题目内容
铝作为材料金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用.
(1)若将铝溶解,下列试剂中最好选用 (填编号).
A.浓硫酸 B.稀硫酸 C.稀硝酸
(2)工业制备金属铝利用含有杂质氧化铁和二氧化硅的铝土矿(主要成分为氧化铝)为原料,先制备Al(OH)3.方法是先在铝土矿中加入硫酸,过滤,然后在滤液中加入过量的NaOH溶液,再过滤,在滤液中通入 (一种过量的气体),该反应的离子方程式 .
(3)工业上用电解熔融Al2O3的方法制备金属铝,其阴极反应式为 .
(4)我国首创以铝、空气、海水为能源的新型电池.该电池以取之不尽的海水为电解液,靠空气中的氧气使铝不断氧化而产生电流.这种海水电池的能量比“干电池”高20~50倍.该新型电池用于航海标志灯已研制成功,只要把灯放入海水中数秒钟,就会发出耀眼的白光.该电池的总反应为:4Al+3O2+6H2O═4Al(OH)3.其负极材料为 ,正极反应式为 .
(5)碱式氯化铝(分子式可表示为Al2(OH)nCl(6-n))是一种新型无机混凝剂,该产品对工业污水、造纸水、印染水具有较好的净化效果.为确定碱式氯化铝分子式中的n值,可采用沉淀称量法.准确称取碱式氯化铝样品4.97g,配制成500mL溶液,用硝酸酸化后,然后逐滴加入过量的AgNO3溶液.然后对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35g. 该碱式氯化铝中的n= .
(1)若将铝溶解,下列试剂中最好选用
A.浓硫酸 B.稀硫酸 C.稀硝酸
(2)工业制备金属铝利用含有杂质氧化铁和二氧化硅的铝土矿(主要成分为氧化铝)为原料,先制备Al(OH)3.方法是先在铝土矿中加入硫酸,过滤,然后在滤液中加入过量的NaOH溶液,再过滤,在滤液中通入
(3)工业上用电解熔融Al2O3的方法制备金属铝,其阴极反应式为
(4)我国首创以铝、空气、海水为能源的新型电池.该电池以取之不尽的海水为电解液,靠空气中的氧气使铝不断氧化而产生电流.这种海水电池的能量比“干电池”高20~50倍.该新型电池用于航海标志灯已研制成功,只要把灯放入海水中数秒钟,就会发出耀眼的白光.该电池的总反应为:4Al+3O2+6H2O═4Al(OH)3.其负极材料为
(5)碱式氯化铝(分子式可表示为Al2(OH)nCl(6-n))是一种新型无机混凝剂,该产品对工业污水、造纸水、印染水具有较好的净化效果.为确定碱式氯化铝分子式中的n值,可采用沉淀称量法.准确称取碱式氯化铝样品4.97g,配制成500mL溶液,用硝酸酸化后,然后逐滴加入过量的AgNO3溶液.然后对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35g. 该碱式氯化铝中的n=
考点:铝的化学性质,化学电源新型电池,电解原理,复杂化学式的确定
专题:计算题,几种重要的金属及其化合物
分析:(1)铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染;
(2)铝土矿中加入硫酸,过滤后的滤液中含有Al3+、Fe3+,加入过量NaOH溶液,前者可转化为AlO2-,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3;
(3)电解熔融氧化铝时,阳极O2-失去电子生成O2,阴极Al3+得电子生成单质Al;
(4)这种新型电池以Al为负极,发生的反应为4Al-12e-═4Al3+,空气中的氧气为正极,发生的反应为3O2+6H2O+12e-═12OH-;
(5)根据题目提供的数据,利用Cl元素守恒可列等式计算.
(2)铝土矿中加入硫酸,过滤后的滤液中含有Al3+、Fe3+,加入过量NaOH溶液,前者可转化为AlO2-,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3;
(3)电解熔融氧化铝时,阳极O2-失去电子生成O2,阴极Al3+得电子生成单质Al;
(4)这种新型电池以Al为负极,发生的反应为4Al-12e-═4Al3+,空气中的氧气为正极,发生的反应为3O2+6H2O+12e-═12OH-;
(5)根据题目提供的数据,利用Cl元素守恒可列等式计算.
解答:
解:(1)A、C中浓硫酸、硝酸与Al反应生成有毒气体,只有B溶解Al最好,故答案为:B;
(2)铝土矿中加入硫酸,过滤后的滤液中含有Al3+、Fe3+,加入过量NaOH溶液,前者可转化为AlO2-,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3,生成沉淀的该组离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:CO2;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)阴极上Al3+得电子生成单质Al,电极反应为Al3++3e-═Al,故答案为:Al3++3e-═Al;
(4)该电池的总反应为4Al+3O2+6H2O═4Al(OH)3,Al元素的化合价升高,失去电子,其负极材料为铝,正极上氧气得到电子,正极反应为3O2+6H2O+12e-═12OH-,
故答案为:铝;3O2+6H2O+12e-═12OH-;
(5)对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35g,沉淀为AgCl,由Cl元素守恒可知:
×(6-n)=
,解得n=1,
故答案为:1.
(2)铝土矿中加入硫酸,过滤后的滤液中含有Al3+、Fe3+,加入过量NaOH溶液,前者可转化为AlO2-,后者转化为Fe(OH)3沉淀,再过滤后的滤液中含有NaAlO2溶液,通入过量二氧化碳,转化为Al(OH)3,生成沉淀的该组离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:CO2;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)阴极上Al3+得电子生成单质Al,电极反应为Al3++3e-═Al,故答案为:Al3++3e-═Al;
(4)该电池的总反应为4Al+3O2+6H2O═4Al(OH)3,Al元素的化合价升高,失去电子,其负极材料为铝,正极上氧气得到电子,正极反应为3O2+6H2O+12e-═12OH-,
故答案为:铝;3O2+6H2O+12e-═12OH-;
(5)对沉淀进行过滤、洗涤、干燥,称取沉淀物质量为14.35g,沉淀为AgCl,由Cl元素守恒可知:
| 4.97 |
| 54+17n+35.5(6-n) |
| 14.35 |
| 143.5 |
故答案为:1.
点评:本题考查较综合,涉及铝的化学性质、原电池及计算等,注重高考高频考点的考查,把握物质的性质及化学反应原理为解答的关键,注意(5)中原子守恒可简化计算,题目难度中等.

练习册系列答案
相关题目
2011年是国际化学年,中国的宣传口号是“化学--我们的生活,我们的未来”.下列有关叙述不正确的是( )
| A、在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 |
| B、利用太阳能、潮汐能、风力发电,以获取清洁能源 |
| C、大量排放SO2或CO2都会导致酸雨的形成 |
| D、采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 |
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
下列物质的分类结果全部正确的是( )
| A、苯酚--有机物 纯碱--盐 水--氧化物 |
| B、淀粉--混合物 胆矾--纯净物 漂白粉--化合物 |
| C、液氯--非电解质 碳酸钙--强电解质 醋酸--弱电解质 |
| D、金刚石--原子晶体 食盐--离子晶体 二氧化硅--分子晶体 |
 用如图所示装置进行实验,实验现象正确的是( )
用如图所示装置进行实验,实验现象正确的是( )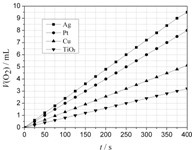 某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: