题目内容
下列排列顺序不正确的是( )
| A、酸性:H3AsO4>H2SO4>H3PO4 |
| B、微粒的半径:Cl->Na+>Mg2+>Al3+ |
| C、热稳定性:HF>HCl>HBr>HI |
| D、熔点:SiO2>NaCl>I2 |
考点:元素周期律和元素周期表的综合应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.非金属性越强,最高价含氧酸的酸性越强;
B.电子层越多,半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
C.非金属性越强,气态氢化物越稳定;
D.一般来说,熔点为原子晶体>离子晶体>分子晶体.
B.电子层越多,半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
C.非金属性越强,气态氢化物越稳定;
D.一般来说,熔点为原子晶体>离子晶体>分子晶体.
解答:
解:A.非金属性S>P>As,最高价含氧酸的酸性为H2SO4>H3PO4>H3AsO4,故A错误;
B.电子层越多,半径越大;具有相同电子排布的离子,原子序数大的离子半径小,则微粒的半径:Cl->Na+>Mg2+>Al3+,故B正确;
C.非金属性F>Cl>Br>I,气态氢化物热稳定性:HF>HCl>HBr>HI,故C正确;
D.一般来说,熔点为原子晶体(SiO2)>离子晶体(NaCl)>分子晶体(I2),故D正确;
故选A.
B.电子层越多,半径越大;具有相同电子排布的离子,原子序数大的离子半径小,则微粒的半径:Cl->Na+>Mg2+>Al3+,故B正确;
C.非金属性F>Cl>Br>I,气态氢化物热稳定性:HF>HCl>HBr>HI,故C正确;
D.一般来说,熔点为原子晶体(SiO2)>离子晶体(NaCl)>分子晶体(I2),故D正确;
故选A.
点评:本题考查微粒性质的比较,为高频考点,涉及非金属性、离子半径、晶体熔点的比较等,涉及知识点较多,注重高频考点的考查,注意归纳规律性知识,题目难度不大.

练习册系列答案
相关题目
下列排列的顺序不正确的是( )
| A、热稳定性:HCl>PH3>H2S |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、原子半径:Na>S>O |
| D、结合氢离子能力:CO32->HCO3->SO42- |
 利用人工光合作用合成甲酸的原理为2CO2+2H2O
利用人工光合作用合成甲酸的原理为2CO2+2H2O| 太阳能 |
| 光触媒 |
| A、该装置将太阳能转化为化学能和电能 |
| B、电极1周围pH增大 |
| C、电极2上发生的反应为:CO2+2H++2e-═HCOOH |
| D、H+由电极1室经过质子膜流向电极2室 |
下列反应的离子方程式不正确的是( )
| A、将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O═2NaHCO3↓ | ||||
| B、在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
| C、向Ba(OH)2溶液中加入足量的NH4HCO3溶液:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | ||||
D、将饱和FeCl3溶液滴入沸水中制胶体:Fe3++3H2O
|
 邻苯二甲酸二丁酯是一种常用的塑化剂,其结构简式如图所示.下列关于塑化剂的说法正确的是( )
邻苯二甲酸二丁酯是一种常用的塑化剂,其结构简式如图所示.下列关于塑化剂的说法正确的是( )| A、能溶于水 |
| B、与乙二酸二乙酯互为同系物 |
| C、可用邻苯二甲酸和丁醇酯化制得 |
| D、完全燃烧1mol该有机物需要436.8L O2 |
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述正确的是( )
| A、放电时,负极反应式为3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时,正极区溶液的pH减小 |
| C、充电时,每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、充电时,电池的锌电极接电源的正极 |
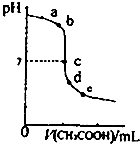 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |
下列化学过程及其表述正确的是( )
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 |
| C、酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
