题目内容
下列反应的离子方程式不正确的是( )
| A、向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
| B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3?H2O+H2O |
| C、在溴化亚铁溶液中通入过量的氯气:Cl2+2Fe2++2Br-═2Fe3++2Cl-+Br2 |
| D、过量CO2通入氢氧化钠溶液中:CO2+OH-═HCO3- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸氢钙完全反应,反应生成碳酸钙、碳酸钠、水;
B.等体积等物质的量浓度,以1:1反应,反应生成碳酸钡、水、一水合氨;
C.过量氯气,溴离子、亚铁离子均被氧化;
D.反应生成碳酸氢钠.
B.等体积等物质的量浓度,以1:1反应,反应生成碳酸钡、水、一水合氨;
C.过量氯气,溴离子、亚铁离子均被氧化;
D.反应生成碳酸氢钠.
解答:
解:A.向碳酸氢钙溶液中加入过量氢氧化钠的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故A正确;
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合的离子反应为Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3?H2O+H2O,故B正确;
C.在溴化亚铁溶液中通入过量的氯气的离子反应为3Cl2+2Fe2++4Br-═2Fe3++6Cl-+2Br2,故C错误;
D.过量CO2通入氢氧化钠溶液中的离子反应为CO2+OH-═HCO3-,故D正确;
故选:C.
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合的离子反应为Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3?H2O+H2O,故B正确;
C.在溴化亚铁溶液中通入过量的氯气的离子反应为3Cl2+2Fe2++4Br-═2Fe3++6Cl-+2Br2,故C错误;
D.过量CO2通入氢氧化钠溶液中的离子反应为CO2+OH-═HCO3-,故D正确;
故选:C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应为解答的关键,注意氧化还原中氧化的先后及与量有关的离子反应为解答的难点,选项C为易错点,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
某温度下,水的离子积常数Kw=10-12.该温度下,将pH=4的硫酸溶液与pH=9的氢氧化钡溶液混合并保持恒温,欲使混合溶液的pH=7,则硫酸溶液和氢氧化钡溶液的体积比为(溶液体积变化忽略不计)( )
| A、1:10 | B、9:1 |
| C、10:1 | D、99:21 |
阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
| A、常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023 | ||
| B、室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023 | ||
| C、标准状况下,22.4 L甲苯所含的分子数约为6.02×1023 | ||
D、标准状况下,a L甲烷和乙烷混合气体中的分子数约为
|
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1mol苯乙烯中含有的碳碳双键数为4NA |
| B、标准状况下,22.4L空气含有NA个单质分子 |
C、0.5mol雄黄(As4S4,结构如图)含有5NA个S-S键 |
| D、1mol铜与足量硫反应,转移的电子总数为NA |
化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.下列化学用语中表述正确的是( )
A、次氯酸的电子式: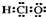 |
| B、二氧化硅的分子式:SiO2 |
C、二氧化碳的比例模型: |
D、Cl-的结构示意图: |
设阿伏加德罗常数的值为NA,下列说法正确的是( )
| A、1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B、标准状况下,2.24L已烷含有原子的数目为2NA |
| C、1mol甲醇中含有C-H键的数目为4NA |
| D、11.2升氯气所含的原子数目一定为NA |
下列制取单质的反应中,化合物作还原剂的是( )
| A、Zn+H2SO4═ZnSO4+H2↑ |
| B、C+2CuO═2Cu+CO2 |
| C、Br2+2NaI═2NaBr+I2 |
| D、Cu+2AgNO3═2Ag+Cu(NO3)2 |
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.