题目内容
(13分)
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153?C)与氢氧化铁制得。其结构如图。

(1)柠檬酸的晶体类型为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为 (填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键 B.极性键 C.非极性键
D.金属键 E.氢键 F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
(13分)
(1)分子晶体 (2分) (2)3d5(2分)(3)H<C<O (2分)
(4)sp2 sp3(2分)(5)< (1分) (6)A D (2分)
(7)H3O+中的O只有1对孤对电子,H2O的O有2对孤对电子(2分)
【解析】
试题分析:(1)分子晶体的熔点较低,已知柠檬酸(熔点为153°C),则柠檬酸为分子晶体。
(2)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,Fe失去三个电子得到Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5;所以基态Fe3+的价电子排布式为3d5。
(3)柠檬酸铁所含非金属元素为H、C、O,其非金属性:O>C>H,非金属性越强,则电负性越大,所以电负性从小到大的顺序为:H<C<O
(4)分子中C=O上的碳原子含有3个价层电子对,以单键形式结合的碳原子的价层电子对数为4,所以柠檬酸铁中,碳原子的杂化方式为:sp2 sp3。
(5)元素原子失去电子所需能量逐渐增大,即同一元素的第一电离能小于第二电离能小于第三电离能,所以I2(Fe)<I3(Fe)。
(6)柠檬酸铁在溶液中电离,离子键被破坏,没有离子键,金属键只存在于金属单质中,所以柠檬酸铁溶液中不存在的微粒间作用力为离子键和金属键,故答案为:AD。
(7)H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大。
考点:本题考查物质结构和性质、晶体类型的判断、原子轨道杂化类型、电负性、化学键、氢键。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案已知:N2(g)+3H2(g) 2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| H2(g) | N2(g) | NH3(g) |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,
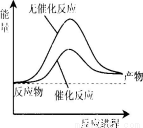
下列说法正确的是
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
 eC(气)+dD(气) △H<0,下列能证明该反应一定达到平衡状态的是
eC(气)+dD(气) △H<0,下列能证明该反应一定达到平衡状态的是