题目内容
16.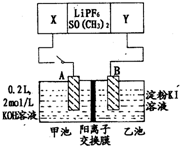 已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )
已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )| A. | 从隔膜中通过的离子数目为0.4 NA | |
| B. | 若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4 mol/L | |
| C. | A电极为阳极 | |
| D. | 电源正极反应式为:FeS+2Li++2e-═Fe+Li2S |
分析 由反应FeS+2Li=Fe+Li2S可知,Li被氧化,应为原电池的负极,FeS被还原生成Fe,为正极反应;甲连接原电池负极,A为阴极,生成氢气,电极方程式为2H++2e-=H2↑,结合电极方程式计算.
解答 解:A、由反应FeS+2Li=Fe+Li2S可知,Li被氧化,应为原电池的负极,FeS被还原生成Fe,为正极反应,正极方程式为FeS+2e-=Fe+S2-,甲连接原电池负极,A为阴极,生成氢气,电极方程式为2H++2e-=H2↑,n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,转移0.4mol电子,生成0.4molOH-,则隔膜H中通过的K+离子数为0.4mol,通过的离子数目为0.4 NA,故A正确;
B、甲连接原电池负极,为阴极,生成氢气,电极方程式为2H++2e-=H2↑,n(H2)=0.2mol,转移0.4mol电子,生成0.4molOH-,则隔膜H中通过的K+离子数为0.4mol,c(OH-)=$\frac{0.2L×2mol/L+0.4mol}{0.2L}$=4mol/L,即电解后甲池中溶液浓度为4 mol/L,故B正确;
C、A电极为阴极,故C错误;
D、FeS被还原生成Fe,为正极反应,正极方程式为FeS+2e-=Fe+S2-,故D正确.
故选C.
点评 本题考查了电解原理,为高频考点,侧重于学生的分析能力和计算能力的考查,明确离子交换膜的作用及阴阳极上发生的反应是解本题关键,计算量较大,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列有关反应进行方向的叙述中不正确的是( )
| A. | 焓变和熵变都与反应的自发性有关,又都不能独立地作为自发性的判据 | |
| B. | -10℃的液态水就会自动结冰成为固态,因为这是熵增的过程 | |
| C. | 大量事实告诉我们,过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率 | |
| D. | 放热反应过程中体系能量降低,因此有自发进行的倾向,但是有些吸热反应也可以自发进行 |
7.有化合物X、Y、Z、W,其焰色反应均为紫色.它们按下列反应式转化:
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
| A. | KCl、KOH、K2CO3、KHCO3 | B. | K2CO3、KOH、K2O2、KHCO3 | ||
| C. | K2SO3、KOH、K2O2、KHCO3 | D. | KHCO3、KOH、K2O2、K2CO3 |
4.下列描述中,不符合生产实际的是( )
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |
8.下列过程属于物理变化的是( )
| A. | 海水晒盐 | B. | 煤的气化 | C. | 石油裂化 | D. | 氨溶于水 |
14.下列所采取方法不正确的是( )
| A. | 乙醇沸点是78.5℃,将含水酒精直接加热蒸馏可制得无水酒精 | |
| B. | 除去二氧化碳气体中混有的少量氯化氢气体,可以将气体通过饱和碳酸氢钠溶液 | |
| C. | 可以用醋酸除去锅炉中的水垢(主要成分为碳酸钙) | |
| D. | 仅采用物理方法无法将晾晒海水得到的粗盐转变为精盐 |
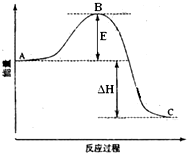 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: .
.
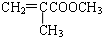 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$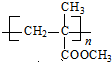 .
.