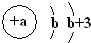题目内容
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:

按要求回答下列问题
(1)第②步操作中,氧化性强弱顺序:ClO3- MnO2 (填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为 mol.NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为 .
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是: .
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是 (填写一组即可).工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为 .

按要求回答下列问题
(1)第②步操作中,氧化性强弱顺序:ClO3-
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是:
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是
考点:物质分离和提纯的方法和基本操作综合应用,氧化性、还原性强弱的比较,电极反应和电池反应方程式,常见化学电源的种类及其工作原理
专题:氧化还原反应专题,电化学专题
分析:粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,
(1)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;根据方程式转移电子数计算生成的氧化产物的物质的量;NaClO3在常温下与盐酸反应生成氯气,根据原子守恒和得失电子守恒写出方程式;
(2)第④步操作中NaOH过量,结合方程式分析;
(3)根据原电池工作原理判断正极发生还原反应,然后根据总反应写出正极的电极反应式;
(4)若沉淀没有洗涤干净,则滤液中含有硫酸根离子;电解时,Mn2+在阳极失电子生成MnO2.
(1)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;根据方程式转移电子数计算生成的氧化产物的物质的量;NaClO3在常温下与盐酸反应生成氯气,根据原子守恒和得失电子守恒写出方程式;
(2)第④步操作中NaOH过量,结合方程式分析;
(3)根据原电池工作原理判断正极发生还原反应,然后根据总反应写出正极的电极反应式;
(4)若沉淀没有洗涤干净,则滤液中含有硫酸根离子;电解时,Mn2+在阳极失电子生成MnO2.
解答:
解:粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,
(1)已知5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;1;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(2)第④步操作中NaOH过量,发生的反应为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,则最终得到的固体除NaClO3外,还有NaOH和NaCl;
故答案为:ad;
(3)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-;
(4)若沉淀没有洗涤干净,则滤液中含有硫酸根离子,检验硫酸根离子选用氯化钡溶液;电解时,Mn2+在阳极失电子生成MnO2,其电极方程式为;Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:氯化钡溶液;Mn2+-2e-+2H2O=MnO2+4H+.
(1)已知5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;1;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(2)第④步操作中NaOH过量,发生的反应为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,则最终得到的固体除NaClO3外,还有NaOH和NaCl;
故答案为:ad;
(3)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-,
故答案为:MnO2+H2O+e-═MnOOH+OH-;
(4)若沉淀没有洗涤干净,则滤液中含有硫酸根离子,检验硫酸根离子选用氯化钡溶液;电解时,Mn2+在阳极失电子生成MnO2,其电极方程式为;Mn2+-2e-+2H2O=MnO2+4H+;
故答案为:氯化钡溶液;Mn2+-2e-+2H2O=MnO2+4H+.
点评:本题考查物质的分离与提纯方法的综合应用,题目难度中等,把握流程中发生的化学反应及原电池和电解池原理为解答的关键,注意掌握化学实验基本操作方法,试题侧重分析能力及推断能力的考查.

练习册系列答案
相关题目
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A、O2在石墨Ⅱ附近发生氧化反应 |
| B、该电池放电时NO3-向石墨Ⅱ电极迁移 |
| C、石墨Ⅰ附近发生的反应:3NO2+2e-=NO+2NO3- |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
下列说法正确的是.
| A、氢化物的沸点:HF<HCl<HBr<HI |
| B、CaF2、CaCl2、CaBr2、CaI2的溶解性依次减小 |
| C、AgF、AgCl、AgBr、AgI的溶解性依次减小 |
| D、F2、Cl2、Br2、I2氧化性逐渐减弱,都能与Fe反应生产Fe3+ |
下列和乙醇相关的化学用语表达正确的是( )
A、乙醇分子中甲基的电子式为 |
| B、乙醇结构简式为:C2H6O |
C、乙醇分子中羟基电子式: |
D、乙醇分子的比例模型为: |