题目内容
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图1所示的装置.
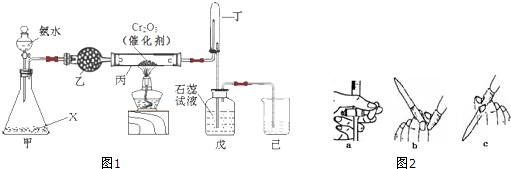
(1)若分液漏斗中氨水的浓度为9.0mol?L-1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 .
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 .
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 .
(4)当戊中观察到 现象,则说明已制得硝酸.某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 .如何改进装置 .
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 ;为测定试管丁内硝酸溶液的浓度,从中取10mL溶液于锥形瓶中,用0.1mol?L-1的NaOH溶液滴定.滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是(图2) .

(1)若分液漏斗中氨水的浓度为9.0mol?L-1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为
(3)乙装置的作用是
(4)当戊中观察到
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据配制溶液的操作步骤判断所用仪器;
(2)甲装置不需要加热即能同时产生氨气和氧气,说明固体X溶于氨水即放热又产生氧气;
(3)乙装置为干燥管,作用是干燥氧气和氨气的混合气体;丙装置发生反应的化学方程式为4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(4)根据硝酸具有酸性,能使紫色石蕊试液变红判断;没有观察到现象说明溶液不呈酸性,则生成的硝酸与碱发生了反应;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶除去多余的氨气确保戊溶液呈酸性;
(5)改进后待反应结束,将丁装置收集的为二氧化氮,倒立在盛水的水槽中,二氧化氮与水反应生成一氧化氮和硝酸,据此分析观察到的现象;滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是b.
(2)甲装置不需要加热即能同时产生氨气和氧气,说明固体X溶于氨水即放热又产生氧气;
(3)乙装置为干燥管,作用是干燥氧气和氨气的混合气体;丙装置发生反应的化学方程式为4NH3+5O2
 4NO+6H2O;
4NO+6H2O;(4)根据硝酸具有酸性,能使紫色石蕊试液变红判断;没有观察到现象说明溶液不呈酸性,则生成的硝酸与碱发生了反应;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶除去多余的氨气确保戊溶液呈酸性;
(5)改进后待反应结束,将丁装置收集的为二氧化氮,倒立在盛水的水槽中,二氧化氮与水反应生成一氧化氮和硝酸,据此分析观察到的现象;滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是b.
解答:
解:(1)量取浓氨水要用量筒,稀释浓氨水要用烧杯、玻璃棒,配制溶液要用100mL容量瓶,胶头滴管,故答案为:胶头滴管、量筒;
(2)甲装置不需要加热即能同时产生氨气和氧气,说明固体X溶于氨水即放热又产生氧气,则该固体为过氧化钠,故答案为:过氧化钠;
(3)乙装置为干燥管,作用是干燥氧气和氨气的混合气体;丙装置发生反应的化学方程式为4NH3+5O2 4NO+6H2O,
4NO+6H2O,
故答案为:干燥氧气和氨气的混合气体; 4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(4)因为硝酸具有酸性,能使紫色石蕊试液变红,所以当戊中观察到紫色石蕊试液变红,说明已制得硝酸;没有观察到现象说明溶液不呈酸性,则生成的硝酸与过量的氨气发生了反应;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶除去多余的氨气确保戊溶液呈酸性,
故答案为:紫色石蕊试液变红;过量的氨气致使戊中溶液不一定呈酸性;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶;
(5)改进后待反应结束,将丁装置收集的为二氧化氮,倒立在盛水的水槽中,二氧化氮与水反应生成一氧化氮和硝酸,所以观察到的现象为烧瓶内水面慢慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色;滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是b,
故答案为:烧瓶内水面慢慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色;b.
(2)甲装置不需要加热即能同时产生氨气和氧气,说明固体X溶于氨水即放热又产生氧气,则该固体为过氧化钠,故答案为:过氧化钠;
(3)乙装置为干燥管,作用是干燥氧气和氨气的混合气体;丙装置发生反应的化学方程式为4NH3+5O2
 4NO+6H2O,
4NO+6H2O,故答案为:干燥氧气和氨气的混合气体; 4NH3+5O2
 4NO+6H2O;
4NO+6H2O;(4)因为硝酸具有酸性,能使紫色石蕊试液变红,所以当戊中观察到紫色石蕊试液变红,说明已制得硝酸;没有观察到现象说明溶液不呈酸性,则生成的硝酸与过量的氨气发生了反应;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶除去多余的氨气确保戊溶液呈酸性,
故答案为:紫色石蕊试液变红;过量的氨气致使戊中溶液不一定呈酸性;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶;
(5)改进后待反应结束,将丁装置收集的为二氧化氮,倒立在盛水的水槽中,二氧化氮与水反应生成一氧化氮和硝酸,所以观察到的现象为烧瓶内水面慢慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色;滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是b,
故答案为:烧瓶内水面慢慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色;b.
点评:本题考查了实验室制氨气的原理和装置以及探究硝酸的制备和性质,同时考查了浓硫酸、氨气等物质的性质应用,难度一般;

练习册系列答案
相关题目
在25℃时,向10mL0.01moL.L-1NaCN溶液滴加入0.01moL.L-1的盐酸,滴定曲线如图1所示,CN-1、HCN浓度所占分数(α)随pH变化的关系如图2所示,下列表述正确的是( )


| A、b点时,溶液中微粒浓度大小的关系:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+) |
| B、d点溶液垂直的关系:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-) |
| C、图2中的e点对应图1中的c点 |
| D、在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小 |
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
| A、R 一定是共价化合物 |
| B、R一定是离子化合物 |
| C、R可能是共价化合物,也可能是离子化合物 |
| D、液态的R一定能导电 |



 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定. X+CH2═CH-R
X+CH2═CH-R CH═CH-R+HX (X为卤素原子,R为取代基)经由Heck反应合成M(一种防晒剂)的路线如下:
CH═CH-R+HX (X为卤素原子,R为取代基)经由Heck反应合成M(一种防晒剂)的路线如下: