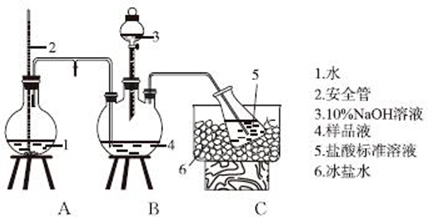
题目内容
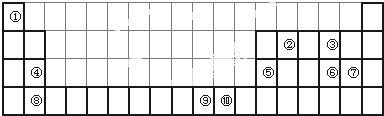
如图为长式周期表的一部分,其中的编号代表对应的元素.
根据上述表格中的十种元素填空:
(1)表中属于ds区的元素是 (填编号).
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是 .
A.分子中含极性共价键 B.含有1个σ键和2个π键
C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)金属性最强的主族元素是 (填元素名称).
(4)⑤、⑥、⑦的离子半径由小到大的顺序是 (填化学式).
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为 个; 该元素与元素①形成的分子X的空间构型为 .

根据上述表格中的十种元素填空:
(1)表中属于ds区的元素是
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是
A.分子中含极性共价键 B.含有1个σ键和2个π键
C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)金属性最强的主族元素是
(4)⑤、⑥、⑦的离子半径由小到大的顺序是
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,
(1)以上元素只有Cu为ds区元素;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,为含极性键的非极性分子,C原子为sp杂化,双键中含1个σ键和1个π键;
(3)以上元素中,金属性最强的为Ca;
(4)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小;
(5)元素的特征电子排布式为nsnnpn+1,s最多有2个电子,所以n=2,即电子排布式为1s22s22p3,该元素为N元素,核外最外层电子的孤对电子数为1,单电子为3,与元素①形成的分子X为NH3,为三角锥型.
(1)以上元素只有Cu为ds区元素;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,为含极性键的非极性分子,C原子为sp杂化,双键中含1个σ键和1个π键;
(3)以上元素中,金属性最强的为Ca;
(4)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小;
(5)元素的特征电子排布式为nsnnpn+1,s最多有2个电子,所以n=2,即电子排布式为1s22s22p3,该元素为N元素,核外最外层电子的孤对电子数为1,单电子为3,与元素①形成的分子X为NH3,为三角锥型.
解答:
解:由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu,
(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,以上元素只有Cu为ds区元素,故答案为:⑩;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,
A.分子中含C、O之间的极性共价键,故A正确;
B.结构式为O=C=O,含有2个σ键和2个π键,故B错误;
C.结构对称,正负电荷中心重合,为含极性键的非极性分子,故C正确;
D.该化合物分子为直线型,②原子采用sp杂化,故D错误;
故答案为:AC;
(3)以上元素中,金属性最强的为Ca,名称为钙,故答案为:钙;
(4)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小,所以离子半径由小到大的顺序为Al3+<Cl-<S2-,
故答案为:Al3+<Cl-<S2-;
(5)元素的特征电子排布式为nsnnpn+1,s最多有2个电子,所以n=2,即电子排布式为1s22s22p3,该元素为N元素,最外层为第2层,2s电子为孤对电子,孤对电子数为1,2p电子均为单电子,则单电子为3,与元素①形成的分子X为NH3,N原子为sp3杂化,空间构型为三角锥型,故答案为:3;三角锥型.
(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,以上元素只有Cu为ds区元素,故答案为:⑩;
(2)②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨,该化合物为CO2,
A.分子中含C、O之间的极性共价键,故A正确;
B.结构式为O=C=O,含有2个σ键和2个π键,故B错误;
C.结构对称,正负电荷中心重合,为含极性键的非极性分子,故C正确;
D.该化合物分子为直线型,②原子采用sp杂化,故D错误;
故答案为:AC;
(3)以上元素中,金属性最强的为Ca,名称为钙,故答案为:钙;
(4)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小,所以离子半径由小到大的顺序为Al3+<Cl-<S2-,
故答案为:Al3+<Cl-<S2-;
(5)元素的特征电子排布式为nsnnpn+1,s最多有2个电子,所以n=2,即电子排布式为1s22s22p3,该元素为N元素,最外层为第2层,2s电子为孤对电子,孤对电子数为1,2p电子均为单电子,则单电子为3,与元素①形成的分子X为NH3,N原子为sp3杂化,空间构型为三角锥型,故答案为:3;三角锥型.
点评:本题考查位置、结构、性质的应用,为高频考点,涉及元素周期表中元素的分区、元素周期表中元素的位置、杂化类型、键的极性与分子极性、分子构型、非金属性比较等,综合性较强,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
分子式为C9H12O,苯环上有两个取代基且含羟基的化合物,其可能的结构有( )
| A、9种 | B、12种 |
| C、15种 | D、16种 |
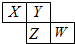 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的| 7 |
| 10 |
| A、XY2和ZY2都是造成酸雨的主要因素 |
| B、Y元素的两种同素异形体在常温下都是气体 |
| C、最高价氧化物对应水化物的酸性W>Z |
| D、氢化物的沸点:HnZ 高于HnY |