题目内容
12.过氧化钠可以与水反应,取7.8克的过氧化钠完全与水反应后,所得溶液的体积为1L,问(1)生成的气体体积在标准状态下为多少升?(2)所得溶液溶质的物质的量浓度是多少?(要求写出计算过程)分析 (1)根据n=$\frac{m}{M}$计算过氧化钠的物质的量,根据反应2Na2O2+2H2O═4NaOH+O2↑计算氧气物质的量,再根据V=nVm计算氧气体积;
(2)根据钠离子守恒计算n(NaOH),再根据c=$\frac{n}{V}$计算NaOH溶液物质的量浓度.
解答 解:(1)过氧化钠的摩尔质量为78g/mol,则n(Na2O2)=$\frac{7.8g}{78g/mol}$0.1mol,
由2Na2O2+2H2O═4NaOH+O2↑可知生成氧气的物质的量为:n(O2)=$\frac{1}{2}$n(Na2O2)=0.05mol,标况下V(O2)=0.05 mol×22.4L/mol=1.12L,
答:标况下生成气体的体积为1.12L;
(2)根据钠离子守恒n(NaOH)=2n(Na2O2)=0.2mol,
所得溶液中氢氧化钠溶液物质的量浓度为:$\frac{0.2mol}{1L}$=0.2mol/L,
答:所得溶液的物质的量浓度为0.2mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.下列物质属于电解质的是( )
| A. | O2 | B. | N2 | C. | CH4 | D. | HCl |
20.下列有关说法正确的是( )
| A. | 能在水溶液电离出H+的物质是酸 | |
| B. | 氧化还原反应中所有元素的化合价均有升降 | |
| C. | 在化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 氧化还原反应的实质是电子的转移(得失或偏移) |
7.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 配制200mL4.6mol•L-1的稀硫酸需取该硫酸50.0mL | |
| D. | 常温下,5.6gFe与足量的稀硫酸反应转移电子的物质的量为0.3mol |
4.下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
| A. | 金属钠 | B. | 溴水 | C. | 碳酸钠溶液 | D. | 稀硫酸 |
20.化学科学需要借助化学语言来描述,下列化学用语正确的是( )
| A. | 甲烷分子的球棍模型: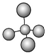 | B. | NH4Br的电子式: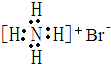 | ||
| C. | 34S2-的结构示意图: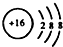 | D. | 邻羟基甲苯酸的结构简式: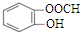 |


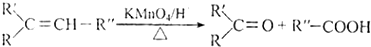
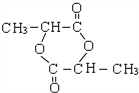
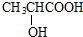 +HBr$\stackrel{△}{→}$CH3CHBrCOOH+H2O
+HBr$\stackrel{△}{→}$CH3CHBrCOOH+H2O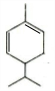 ,A与等物质的量的Br2进行加成反应的产物共有3种.(不考虑立体异构)
,A与等物质的量的Br2进行加成反应的产物共有3种.(不考虑立体异构)