题目内容
7.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该硫酸的物质的量浓度为1.84mol/L | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 配制200mL4.6mol•L-1的稀硫酸需取该硫酸50.0mL | |
| D. | 常温下,5.6gFe与足量的稀硫酸反应转移电子的物质的量为0.3mol |
分析 A.根据c=$\frac{1000ρω}{M}$进行计算该浓硫酸的物质的量浓度;
B.稀释浓硫酸应该将浓硫酸倒入水中;
C.根据配制过程中硫酸的物质的量不变计算浓硫酸体积;
D.铁与稀硫酸反应生成的是亚铁离子.
解答 解:A.该浓硫酸的物质的量浓度=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.稀释浓硫酸应该将浓硫酸倒入水中,并不断搅拌,防止溅出液体,故B错误;
C.浓硫酸的物质的量浓度为18.4mol/L,配制过程中溶质的物质的量不变,则需要浓硫酸的体积=$\frac{4.6mol/L×0.2L}{18.4mol/L}$=50.0mL,故C正确;
D.5.6gFe的物质的量为0.1mol,0.1mol铁与稀硫酸完全反应生成0.1mol亚铁离子,转移了0.2mol电子,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算与判断,涉及浓硫酸的稀释、物质间的反应、物质的量浓度的计算等知识,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握浓硫酸的稀释方法.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
18.1molFeCl3中的Cl-的物质的量是( )
| A. | 3mol | B. | 1.5mol | C. | 1mol | D. | 0.5mol |
2.下列有关概念的说法正确的是( )
| A. | 阿伏伽德罗常数就是6.02×1023 mol-1 | |
| B. | 摩尔质量就是1 mol物质的质量 | |
| C. | 物质的量是衡量物质所含一定数目微观粒子集合体的物理量 | |
| D. | 物质的量的单位--摩尔只适用于微观粒子分子、原子和离子 |
19.下列离子方程式的书写正确的是( )
| A. | NaOH溶液中通入过量的CO2:CO2+2OH-═CO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的浓HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | NaHCO3溶液中加入少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
16.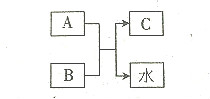 A.B.C均为中学化学常见物质,A、B、C含有同一种元素.且相同的元素不是氢或氧元素.A是一种强酸,B是-种弱碱,C是-种正盐,三者之间的转化关如图所示.则下列说法正确的是.
A.B.C均为中学化学常见物质,A、B、C含有同一种元素.且相同的元素不是氢或氧元素.A是一种强酸,B是-种弱碱,C是-种正盐,三者之间的转化关如图所示.则下列说法正确的是.
 A.B.C均为中学化学常见物质,A、B、C含有同一种元素.且相同的元素不是氢或氧元素.A是一种强酸,B是-种弱碱,C是-种正盐,三者之间的转化关如图所示.则下列说法正确的是.
A.B.C均为中学化学常见物质,A、B、C含有同一种元素.且相同的元素不是氢或氧元素.A是一种强酸,B是-种弱碱,C是-种正盐,三者之间的转化关如图所示.则下列说法正确的是.| A. | C是硝酸盐 | B. | A是硫酸 | C. | B是氢氧化钠 | D. | A的摩尔质量最大 |
15.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
| A. | Cl-、Mg2+、AlO2-、Zn2+、SO42- | B. | Na+、Ba2+、NO3-、OH-、SO42- | ||
| C. | K+、NO3-、SO42-、OH-、Na+ | D. | MnO4-、K+、Cl-、H+、SO42- |