题目内容
10.下列离子反应方程式正确的是( )| A. | 向Ca(HCO3)2溶液加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向NH4HCO3溶液中滴入少量NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | FeSO4溶液在空气中变黄色:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 用NaOH溶液吸收NO2气体:3NO2+2NaOH═2NaNO3+NO↑+H2O |
分析 A.氢氧化钠过量,反应生成碳酸钙、碳酸钠和水;
B.氢氧化钠少量,碳酸氢根离子优先反应;
C.亚铁离子在空气中被氧气氧化成铁离子;
D.氢氧化钠溶液与二氧化氮反应生成亚硝酸钠、硝酸钠和水.
解答 解:A.向Ca(HCO3)2溶液加入过量的NaOH溶液,反应生成碳酸钠、碳酸钙和水,正确的离子方程式为:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O,故A错误;
B.向NH4HCO3溶液中滴入少量NaOH溶液,碳酸氢根离子优先与氢氧根离子反应,正确的离子方程式为:HCO3-+OH-═CO32-+H2O,故B错误;
C.FeSO4溶液在空气中被氧化成硫酸铁,溶液变黄色,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,故C正确;
D.氢氧化钠溶液与二氧化氮反应生成亚硝酸钠、硝酸钠和水,正确的化学方程式为:2NO2+2NaOH═NaNO2+NaNO3+H2O,离子方程式为:2NO2+2OH-═NO2-+NO3-+H2O,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20. 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.
(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.15mol/(L.min);n3=n4(填“>”、“<”或“=”),该反应的平衡常数的值为2.8.
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
1.下列反应中,过氧化钠既不作氧化剂也不作还原剂的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2CO2═2NaCO3+O2 | |
| C. | Na2O2+H2SO4(稀)═Na2SO4+H2O2 | |
| D. | Fe2O3+3Na2O2(熔融)═2Na2FeO4十Na2O |
18.下列离子方程式正确的是( )
| A. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH${\;}_{4}^{+}$+Al3++2SO${\;}_{4}^{2-}$+2Ba2++5OH-═AlO+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2═Ca2++ClO-+Cl-+H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
5.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+O2(g)═2CO2(g),△H=-566kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s),△H=-825.5kJ•mol-1
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=-23.5 kJ•mol-1.
Ⅱ.反应 $\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题: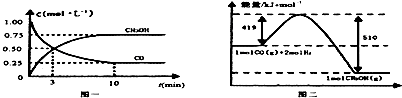
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
则下列关系正确的是ADE.
A c1=c2B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2))kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向正(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
I.已知:2CO(g)+O2(g)═2CO2(g),△H=-566kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s),△H=-825.5kJ•mol-1
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=-23.5 kJ•mol-1.
Ⅱ.反应 $\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
则下列关系正确的是ADE.
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
E.该反应若生成1mol CH3OH,则放出(Q1+Q2))kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向正(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
15.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWuthrich 等人为此获得2002年诺贝尔化学奖.下面有关13C、15N的叙述中正确的是( )
| A. | 13C与15N有相同的中子数 | |
| B. | 13C一种同位素14C具有放射性,14C不可用于考古断代,推算出文物的年代 | |
| C. | 一个15N的质量约为2.5×10-25 kg | |
| D. | 15N的核外电子数与中子数不相同 |
2.下列各说法中,正确的是( )
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数也可以是小数 | |
| C. | 1molH2SO4和1mo Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1molH2和0.5mol O2反应放出的热就是H2的燃烧热 |
19.下列离子能大量共存的是( )
| A. | Na+、H+、NO3-、CO32- | B. | Na+、Fe3+、I-、SO42- | ||
| C. | K+、Cu2+、SO42-、OH- | D. | Na+、Fe3+、NO3-、Cl- |
20.下列说法正确的是( )
| A. | 强弱电解质的区别是溶液的导电能力大小 | |
| B. | 溶液与胶体的本质区别是有无丁达尔效应 | |
| C. | 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| D. | 约含6.02×1023个Na+的Na2O2投入水中配成1L溶液,Na+的物质的量浓度为1mol/L |