题目内容
14.己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表: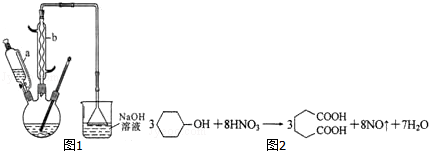
| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min,直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)本实验所用50%的硝酸物质的量浓度为10.4mol/L.滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)仪器b的名称为球形冷凝管,使用时要从下口通入冷水.
(3)NaOH溶液的作用是吸收NO2,防止污染空气,溶液上方倒扣的漏斗作用是防止液体倒吸.
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成较严重的后果,试列举两条可能的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(6)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
分析 (1)根据c=$\frac{1000ρω}{M}$计算该硝酸的物质的量浓度;平衡滴液漏斗与三颈烧瓶内压强,便于液体顺利流下;
(2)仪器b为球形冷凝管;采取逆流原理通入冷凝水,使冷凝管中充满冷凝水,充分冷凝回流;
(3)产物有NO,易与空气中的氧气反应生成NO2,会污染空气;溶液上方倒扣的漏斗作用;防止液体倒吸;
(4)将三颈烧瓶置于冰水浴中冷却;
(5)反应液暴沸冲出冷凝管,放热过多可能引起爆炸,产生的二氧化氮气体来不及被碱液吸收;
(6)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度随温度升高增大,可用冰水洗涤,除去环己醇、硝酸,己二酸不溶于苯,而环己醇易溶于苯,要减小因洗涤导致的损失,可以用苯洗涤.
解答 解:(1)根据c=$\frac{1000ρω}{M}$,可知50%的硝酸(密度为1.31g/cm3)的物质的量浓度为$\frac{1000×1.31×50%}{63}$mol/L=10.4mol/L,
滴液漏斗的细支管a的作用是:平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下,
故答案为:10.4mol/L;平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下;
(2)该仪器有球形区域,仪器b为球形冷凝管,采取逆流原理通入冷凝水,使冷凝管中充满冷凝水,使挥发的有机物进行冷凝回流,提高原料利用率,即从冷凝管的下口通入,从上口流出,
故答案为:球形冷凝管;下口;
(3)根据环己醇氧化生成己二酸方程式可知,产物有NO,一氧化氮易与空气中的氧气反应:2NO+O2=2NO2,二氧化氮中的氮为+4价,在碱性条件下发生岐化反应,氮元素化合价从+4→+5,+4→+3,反应为:2NO2+2NaOH=NaNO3+NaNO2+H2O,所以NaOH溶液的作用是吸收NO2,防止污染空气,倒扣的漏斗下端直径较大,液体上升的速率减慢,能起缓冲作用,防止倒吸,
故答案为:吸收NO2,防止污染空气;防止液体倒吸;
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,反应温度过高时,可将三口烧瓶置于冷水浴中进行降温,
故答案为:将三口烧瓶置于冷水浴中;
(5)向三口烧瓶中滴加环己醇时,反应温度迅速上升,说明该反应为放热反应,需控制好环己醇的滴入速率,如果环己醇的滴入速率过快,反应温度高,反应液暴沸冲出冷凝管;可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中,
故答案为:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中;
(6)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,温度高溶解度大,可用冰水洗涤,除去环己醇、硝酸,己二酸不溶于苯,最后用苯洗涤晶体,除去表面的杂质,避免产品损失,
故答案为:冰水;苯.
点评 本题考查有机物的制备实验,涉及对反应原理的分析、仪器的识别、物质分离提纯、对操作与装置的分析评价等,侧重考查学生对信息的获取与迁移应用,难度中等.

| A. | 4 | B. | 7 | C. | 8 | D. | 11 |
| A. | 20种 | B. | 29种 | C. | 30种 | D. | 48种 |
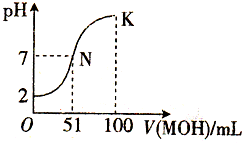 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
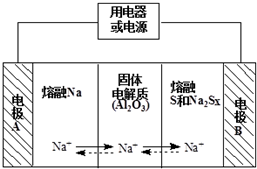 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )| A. | 放电时,内电路中的Na+的从B向A移动 | |
| B. | 充电时,电极A接电源的正极 | |
| C. | 充电时,总反应为2Na+xS=Na2Sx | |
| D. | 放电时,正极的电极反应式为xS+2e-=Sx2- |
 .
. .
. 、
、

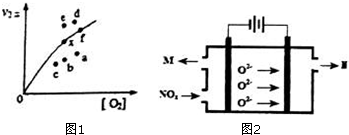 研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知