题目内容
15.水溶液中能大量共存的一组离子是( )| A. | Na+、Ca2+、Cl-、SO42- | B. | Al3+、Na+、SO32-、HCO3- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、OH- |
分析 A.钙离子与硫酸根离子反应;
B.铝离子与碳酸氢根离子、亚硫酸根离子发生双水解反应;
C.四种离子之间不反应,能够共存;
D.铁离子与氢氧根离子反应生成氢氧化铁沉淀.
解答 解:A.Ca2+、SO42-之间反应生成微溶物硫酸钙,在溶液中不能大量共存,故A错误;
B.Al3+与SO32-、HCO3-之间发生双水解反应,在溶液中不能大量共存,故B错误;
C.Mg2+、NH4+、Cl-、SO42-之间不反应,在溶液中能够大量共存,故C正确;
D.Fe3+、OH-之间反应生成难溶物氢氧化铁,装置溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列水溶液凝固点最高的是( )
| A. | 0.1mol/LKCl | B. | 0.1mol/LCH3COOH | C. | 0.1mol/LHCl | D. | 0.1mol/LK2SO4 |
6.NA代表阿伏加德罗常数值.下列叙述正确的是( )
| A. | 37g丙酸中存在的羧基数目为NA | |
| B. | 1L0.1mol•L-1H2SO3溶液中HSO3-和SO32-离子数之和为0.1NA | |
| C. | 0.5molK在空气中燃烧生成多种氧化物,充分燃烧时转移电子数为NA | |
| D. | 在标准状况下,11.2L乙烷分子所含质子数为9NA |
20.下列制定反应的离子方程式正确的是( )
| A. | Cu(OH)2溶于醋酸:Cu(OH)2+2H+═Cu2++2H2O | |
| B. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| C. | AgCl悬浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 明矾溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++4OH-═2AlO2-+3BaSO4↓+2H2O |
4.一定温度下,将0.1molAgCl加入1L 0.1mol•L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是( )
| A. | 相同温度下,AgCl的溶解性比Ag2CO3强 | |
| B. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| C. | 混合后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c(H+) | |
| D. | 混合后溶液中的:c(Na+)+c(H+)+c(Ag+)=2 c(CO32-)+c(HCO3-)+c(OH-) |
5.鉴别固体Na2CO3和NaHCO3的最好方法是( )
| A. | 分别与同浓度的稀盐酸反应 | B. | 分别加入NaOH溶液 | ||
| C. | 分别加入石灰水 | D. | 溶于水,比较其溶解性 |
 如图所示,A处通气体,B处加热一段时间后,停止加热,观察现象:
如图所示,A处通气体,B处加热一段时间后,停止加热,观察现象: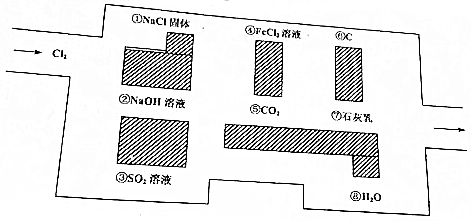
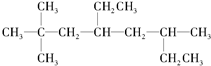 的系统名称是2,2,6-三甲基-4-乙基辛烷,其一氯代物有10种.
的系统名称是2,2,6-三甲基-4-乙基辛烷,其一氯代物有10种. 在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷. 的分子式为C4H8O;
的分子式为C4H8O; 名称为:1,2-二甲基苯(或邻二甲苯).
名称为:1,2-二甲基苯(或邻二甲苯).