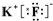题目内容
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1L 0.1 mol•L-1的NaOH溶液中氧原子个数为0.1NA | |
| B. | 常温常压下,15g甲基(-CH3)所含的中子数为9NA | |
| C. | 0.1 mol钠与足量O2充分反应时,转移的电子数为0.1NA | |
| D. | 0.2 mol SO2与0.1mol O2充分反应,产物的分子数为0.2NA |
分析 A、氢氧化钠溶液中除了氢氧化钠后,水也含氧原子;
B、求出甲基的物质的量,然后根据甲基中含6个中子来分析;
C、钠和氧气反应后变为+1价;
D、二氧化硫和氧气的反应为可逆反应.
解答 解:A、氢氧化钠溶液中除了氢氧化钠后,水也含氧原子,故溶液中的氧原子的个数多于0.1NA个,故A错误;
B、15g甲基的物质的量为1mol,而甲基中含6个中子,故1mol甲基中含6NA个中子,故B错误;
C、钠和氧气反应后变为+1价,故0.1mol钠反应后转移0.1NA个电子,故C正确;
D、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故产物分子个数小于0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.进行化学实验必须注意安全.下列说法正确的是( )
| A. | 不能用手直接接触药品 | B. | 可用酒精灯对烧杯直接加热 | ||
| C. | 用鼻孔凑到容器口去闻气体的气味 | D. | 尝一下实验室里酒精的味道 |
14.现有质量均为4.2克的气体A和气体B,其摩尔质量之比7:8,在标况下气体A的体积约为3.36升,则在标况下气体B的体积约为( )
| A. | 1.12升 | B. | 2,24升 | C. | 2.94升 | D. | 5.88升 |
4.维生素A的结构简式如图所示,关于它的叙述中正确的是( )

| A. | 维生素A能发生取代、加成、酯化反应 | |
| B. | 维生素A不能与金属钠反应产生氢气 | |
| C. | 维生素A不能使酸性KMnO4溶液褪色 | |
| D. | 维生素A属于不饱和烃 |
11.下列离子组在指定溶液中能大量共存的是( )
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
8.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
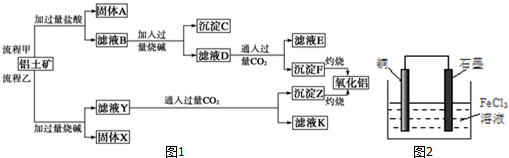
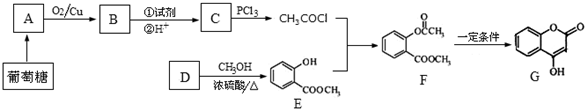
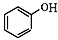 +NaOH→
+NaOH→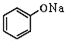 +H2O
+H2O .
.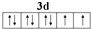 ,写出A、B形成化合物的电子式
,写出A、B形成化合物的电子式