题目内容
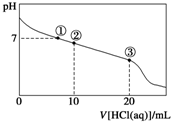 常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点①所示溶液中:c(CH3COOH)=c(Cl-)>c(Na+)>c(OH-)=c(H+) |
| B、点②所示溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH) |
| C、点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D、整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.点①溶液pH=7,结合溶液的电荷守恒、物料守恒进行判断各离子浓度大小;
B.点②时,溶液中存在CH3COONa和CH3COOH,溶液呈酸性,应有c(CH3COO-)>c(Cl-);
C.点③时,恰好反应生成CH3COOH,CH3COOH为弱电解质,不完全电离,溶液呈酸性;
D.根据整个过程中溶液遵循物料守恒进行判断.
B.点②时,溶液中存在CH3COONa和CH3COOH,溶液呈酸性,应有c(CH3COO-)>c(Cl-);
C.点③时,恰好反应生成CH3COOH,CH3COOH为弱电解质,不完全电离,溶液呈酸性;
D.根据整个过程中溶液遵循物料守恒进行判断.
解答:
解:A.A.溶液存在电荷守恒:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)+c(Cl-)和物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-),点①溶液pH=7,c(H+)c(OH-),根据以上关系可得c(CH3COOH)=c(Cl-),c(Na+)>c(CH3COO-),该溶液中离子浓度大小关系为:c(Na+)>c(CH3COOH)=c(Cl-)>c(OH-)=c(H+),故A错误;
B.点②时,加入盐酸10mL,溶液中存在CH3COONa和CH3COOH,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,应有c(CH3COO-)>c(Cl-),根据物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-)可得c(Na+)>c(CH3COO-),则溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH),故B正确;
C.点③时,恰好反应生成CH3COOH,CH3COOH为弱电解质,醋酸部分电离,溶液呈酸性,则c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-),故C错误;
D.整个过程中,溶液存在物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-),故D错误;
故选B.
B.点②时,加入盐酸10mL,溶液中存在CH3COONa和CH3COOH,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-水解程度,应有c(CH3COO-)>c(Cl-),根据物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-)可得c(Na+)>c(CH3COO-),则溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH),故B正确;
C.点③时,恰好反应生成CH3COOH,CH3COOH为弱电解质,醋酸部分电离,溶液呈酸性,则c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-),故C错误;
D.整个过程中,溶液存在物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-),故D错误;
故选B.
点评:本题考查了酸碱混合的定性判断及溶液pH的计算、溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,要求学生能够根据电荷守恒、物料守恒、盐的水解原理判断溶液中离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有a、b、c、d 4种金属,将a与b用导线连接起来,浸入NaCl溶液中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将铜浸在b盐溶液中,无明显变化;如果把铜浸入c的盐溶液中,有金属c析出.据此判断它们的活动性由强到弱的顺序是( )
| A、d>c>a>b |
| B、b>a>d>c |
| C、d>b>a>c |
| D、d>a>b>c |
下列关于有机物的说法不正确的是( )
| A、可以用水来鉴别苯和CCl4 |
| B、CH2Cl2有两种同分异构体 |
| C、煤的干馏属于化学变化 |
| D、加热能杀死H7N9禽流感病毒是因为构成病毒的蛋白质受热变性 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA |
| B、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| C、在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
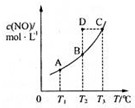 在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)?CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示,则下列说法中,正确的是( )| A、该反应的△H>0 |
| B、若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
| C、在T2时,若反应体系处于状态D,则这时一定有v正<v负 |
| D、在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C |
 2013年12月2日1时30分,搭载着嫦娥三号的长征三号乙运载火箭在西昌卫星发射中心发射升空并准确入轨,发射圆满成功.火箭的一子级、助推器和二子级使用偏二甲肼[(CH3)2NNH2,结构如图所示]和N2O4作为推进剂,反应如下:(CH3)2NNH2+2N2O4═2CO2↑+4H2O↑+3N2↑,下列有关说法正确的是( )
2013年12月2日1时30分,搭载着嫦娥三号的长征三号乙运载火箭在西昌卫星发射中心发射升空并准确入轨,发射圆满成功.火箭的一子级、助推器和二子级使用偏二甲肼[(CH3)2NNH2,结构如图所示]和N2O4作为推进剂,反应如下:(CH3)2NNH2+2N2O4═2CO2↑+4H2O↑+3N2↑,下列有关说法正确的是( )| A、设NA为阿伏伽德罗常数的值,则46g NO2和N2O4的混合气体含有的氧原子数在2NA到4NA之间 |
| B、偏二甲肼分子中既含σ键又含π键 |
| C、(CH3)2NNH2和N2O4都属于分子晶体 |
| D、每反应1mol (CH3)2NNH2有44.8L N2O4被还原 |
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(OH-)>c(A2-)>c(H+) |
| B、等体积等浓度的NaOH溶液与H2A溶液混合,其溶液中水的电离程度比纯水的大 |
| C、向Na2A溶液加入水的过程中,pH可能增大也可能减小 |
| D、NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( )
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、涤纶、塑料、光导纤维都是有机高分子材料 |
| C、用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D、外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
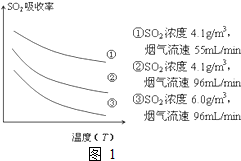 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.