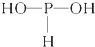题目内容
现有三个氧化还原反应:①2FeCl3+2KI═2FeCl2+2KCl+I2 ②2FeCl2+Cl2═2FeCl3 ③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(1)若某溶液中有Fe2+、Cl-和I-共存,欲氧化除去I-而又不影响Fe2+和Cl-,从上述反应物中可选出加入合适的试剂是 .
(2)在强酸性溶液中,将含有MnO4-、Fe3+、Fe2+和I-等四种离子的溶液混合,充分反应后:
①若溶液中有I-剩余,则溶液中还可能有上述四种离子中的 ,一定没有的是 .
②若溶液中Fe3+有剩余,则溶液中还可能有上述四种离子中的 ,一定没有的是 .
③若溶液中Fe2+有剩余,则溶液中还可能有上述四种离子中的 ,一定没有的是 .
④若溶液中MnO4-有剩余,则溶液中还可能有上述四种离子中的 ,一定没有的是 .
(1)若某溶液中有Fe2+、Cl-和I-共存,欲氧化除去I-而又不影响Fe2+和Cl-,从上述反应物中可选出加入合适的试剂是
(2)在强酸性溶液中,将含有MnO4-、Fe3+、Fe2+和I-等四种离子的溶液混合,充分反应后:
①若溶液中有I-剩余,则溶液中还可能有上述四种离子中的
②若溶液中Fe3+有剩余,则溶液中还可能有上述四种离子中的
③若溶液中Fe2+有剩余,则溶液中还可能有上述四种离子中的
④若溶液中MnO4-有剩余,则溶液中还可能有上述四种离子中的
考点:氧化性、还原性强弱的比较
专题:
分析:(1)反应①中氧化性:Fe3+>I2;还原性:I->Fe2+;
反应②中氧化性:Cl2>Fe3+;还原性:Fe2+>Cl-;
反应③中氧化性:MnO4->Cl2;还原性:Cl->Mn2+,
所以氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2;
欲氧化除去I-而又不影响Fe2+和Cl-,即不能引进新的杂质;
(2)①若溶液中有I-剩余,则溶液中一定没有氧化性大于碘的离子,可能存在亚铁离子;
②若溶液中Fe3+有剩余,则溶液中一定不存在还原性离子,可能存在;
③若溶液中Fe2+有剩余,则溶液中一定不存在强氧化性离子;
④若溶液中MnO4-有剩余,则溶液中一定没有还原性离子.
反应②中氧化性:Cl2>Fe3+;还原性:Fe2+>Cl-;
反应③中氧化性:MnO4->Cl2;还原性:Cl->Mn2+,
所以氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2;
欲氧化除去I-而又不影响Fe2+和Cl-,即不能引进新的杂质;
(2)①若溶液中有I-剩余,则溶液中一定没有氧化性大于碘的离子,可能存在亚铁离子;
②若溶液中Fe3+有剩余,则溶液中一定不存在还原性离子,可能存在;
③若溶液中Fe2+有剩余,则溶液中一定不存在强氧化性离子;
④若溶液中MnO4-有剩余,则溶液中一定没有还原性离子.
解答:
解:(1)反应①中氧化性:Fe3+>I2;还原性:I->Fe2+;
反应②中氧化性:Cl2>Fe3+;还原性:Fe2+>Cl-;
反应③中氧化性:MnO4->Cl2;还原性:Cl->Mn2+,
所以氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2;
欲氧化除去I-而又不影响Fe2+和Cl-,即不能引进新的杂质,应该选用FeCl3,
故答案为:FeCl3;
(2)①若溶液中有I-剩余,则溶液中一定没有氧化性大于碘的离子,所以一定不存在MnO4-、Fe3+,亚铁离子和碘离子不反应,所以可能存在Fe2+,故答案为:Fe2+;MnO4-、Fe3+;
②若溶液中Fe3+有剩余,则溶液中一定不存在还原性离子I-,可能存在MnO4-或Fe2+,故答案为:MnO4-或Fe2+;I-;
③若溶液中Fe2+有剩余,则溶液中一定不存在强氧化性离子MnO4-,可能存在Fe3+或I-,
故答案为:MnO4-;Fe3+或I-;
④若溶液中MnO4-有剩余,则溶液中可能存在Fe3+,一定没有还原性离子Fe2+和I-,
故答案为:Fe3+;Fe2+和I-.
反应②中氧化性:Cl2>Fe3+;还原性:Fe2+>Cl-;
反应③中氧化性:MnO4->Cl2;还原性:Cl->Mn2+,
所以氧化性由强至弱的顺序为:MnO4->Cl2>Fe3+>I2;
欲氧化除去I-而又不影响Fe2+和Cl-,即不能引进新的杂质,应该选用FeCl3,
故答案为:FeCl3;
(2)①若溶液中有I-剩余,则溶液中一定没有氧化性大于碘的离子,所以一定不存在MnO4-、Fe3+,亚铁离子和碘离子不反应,所以可能存在Fe2+,故答案为:Fe2+;MnO4-、Fe3+;
②若溶液中Fe3+有剩余,则溶液中一定不存在还原性离子I-,可能存在MnO4-或Fe2+,故答案为:MnO4-或Fe2+;I-;
③若溶液中Fe2+有剩余,则溶液中一定不存在强氧化性离子MnO4-,可能存在Fe3+或I-,
故答案为:MnO4-;Fe3+或I-;
④若溶液中MnO4-有剩余,则溶液中可能存在Fe3+,一定没有还原性离子Fe2+和I-,
故答案为:Fe3+;Fe2+和I-.
点评:本题考查氧化性、还原性强弱比较,明确离子的性质是解本题关键,会根据方程式判断氧化性、还原性强弱,根据氧化性、还原性强弱判断离子共存,注意铁离子和亚铁离子不反应,题目难度中等.

练习册系列答案
相关题目
下列有关叙述正确的是( )
| A、氢键是一种特殊化学键,它广泛地存在于自然界中 |
| B、在CH3-CH-COOH分子中含有1个手性C原子 |
| C、碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 |
| D、含氧酸可用通式XOm(OH)n表示,若n值越大,则含氧酸的酸性越大 |
海战中常使用烟草弹是由液氨、SiCl4等物质混合物.用粗硅和氯气通过加热制得的SiCl4中往往含有FeCl3、AlCl、PCl5等杂质,已知SiCl4、FeCl3、AlCl、PCl5等都是极易发生水解反应.下列有关说法正确的是( )
| A、浓烟主要是由生成的大量NH4Cl造成的 |
| B、以上物质的水解都生成对应的酸和碱 |
| C、CCl4和SiCl4的分子结构相似,故CCl4也容易发生水解 |
| D、NH3属于弱电解质 |
下列图象中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是( )
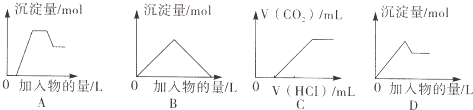

| A、图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线 |
| B、图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C、图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D、图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线 |
有机物A的化学式为C3H6O2,水解后得到一元酸M和一元醇N,已知M、N的相对分子质量相等,则下列叙述中,不正确的是( )
| A、N、M均不能发生银镜反应 |
| B、M中没有甲基 |
| C、M中含碳量为26.1% |
| D、N中含有甲基 |
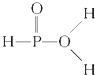
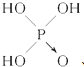 )中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
)中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )