题目内容
6.下表为元素周期表的一部分,参照元素①~⑧在表中的位置,请回答下列问题.族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.(2)③、④、⑧的原子中半径最大的是④(写编号).
(3)④和⑥的最高价的氧化物的水化物中碱性强的是NaOH.②和⑦的气态氢化物中的稳定性强的是H2O(均填化学式).
(4)写出一种由①②组成且含有非极性键的物质的电子式
 .
.
分析 由元素在周期表的为可知,①~⑧分别为H、O、F、Na、Mg、Al、P、Cl,
(1)⑤的离子的质子数为12,电子数为10;
(2)电子层越多,原子半径越大,同周期从左向右原子半径减小;
(3)金属性越强,最高价的氧化物的水化物的碱性越强;非金属性越强,对应氢化物越稳定;
(4)①②组成且含有非极性键的物质为过氧化氢.
解答 解:(1)⑤的离子的质子数为12,电子数为10,其离子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)电子层越多,原子半径越大,同周期从左向右原子半径减小,则③、④、⑧的原子中半径最大的是④,故答案为:④;
(3)金属性越强,最高价的氧化物的水化物的碱性越强,则④和⑥的最高价的氧化物的水化物中碱性强的是NaOH;非金属性越强,对应氢化物越稳定,则②和⑦的气态氢化物中的稳定性强的是H2O,
故答案为:NaOH;H2O;
(4)①②组成且含有非极性键的物质为过氧化氢,其电子式为 ,
,
故答案为: .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.25℃、101kPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件下,单位质量的物质完全燃烧所放出的热量)依次是33kJ•g-1、143kJ•g-1、56kJ•g-1、23kJ•g-1.则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-896 kJ•mol-1 | |
| D. | CH3OH(l)+O2(g)=CO2(g)+2H2O (l)△H=-736 kJ•mol-1 |
11.根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
(1)能显+1价,还能显-1价的元素是H(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为NaOH、Mg(OH)2、Al(OH)3(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为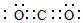 .
.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)③的单质在空气中充分燃烧的化学方程式是4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O.④与⑥形成的稳定化合物的电子式为
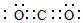 .
.(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为NH4NO3,其中含有的化学键为离子键和共价键.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈黄色.⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
18.有一种线性高分子,结构如图所示.
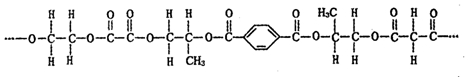
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 该高分子由4种单体(聚合成髙分子的简单小分子)缩聚而成 | |
| B. | 构成该分子的几种竣酸单体互为同系物 | |
| C. | 上述单体中的乙二醇,可被02催化氧化生成单体之一的草酸 | |
| D. | 该高分子有固定熔沸点,1 mol上述链节完全水解需要氢氧化钠物质的量为 5 mol |
15.已知卤代烃可以和钠发生反应,例如溴乙烷与钠反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr.已知有CH3CH2Br和CH3CH2CH2CH2Br两种卤代烃,此混合物与足量的钠反应,得到的烃可能有几种( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.工业制硝酸时,NH3在500℃时可以发生如下3个反应,下列说法正确的是( )
| 反应 | △H(kJ•mol-1) | 平衡常数K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大压强,则反应②的K 不变,反应①和③的K 减小 | |
| C. | 500℃,2N2O(g)+O2(g)?4 NO(g) K=4×102 | |
| D. | 使用合适的催化剂可提高反应的选择性,提高NO 的产出率 |
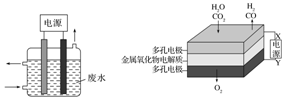 用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;