题目内容
9.在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )| A. | 物质A的转化率小了 | B. | 平衡向正反应方向移动了 | ||
| C. | 物质B的质量分数减小了 | D. | b>a |
分析 先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,据此结合选项判断.
解答 解:A.先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,反应物转化率增大,故A错误;
B.根据A的判断,实际平衡时B的浓度比假设大,说明平衡向生成B的方向移动,平衡向正反应方向移动了,故B正确;
C.平衡向正反应移动,B的质量增大,混合气体的总质量不变,故物质B的质量分数增大,故C错误;
D.根据A的判断,平衡向生成B的方向移动,减小压强平衡向正反应方向移动,则a<b,故D正确;
故选BD.
点评 本题考查化学平衡移动等,难度不大,注意利用假设法分析、判断平衡移动方向.

练习册系列答案
相关题目
16.下列有关实验操作分析正确的是( )
| A. | 从溴水中萃取溴,可用酒精做萃取剂 | |
| B. | 蒸发实验完毕后,发现蒸发皿炸裂,这是因为没有垫石棉网 | |
| C. | 萃取碘水溶液中碘,分离碘四氯化碳溶液时,眼睛注视分液漏斗里液面 | |
| D. | 蒸馏时,为了加快水的流速,水应从上口进入,下口流出 |
20. 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:增大乙醇浓度、移去生成物等.
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为原料来不及反应就被蒸出、温度过高发生副反应等.
(3)此反应以浓硫酸为催化剂,可能会造成产生大量酸性废液污染环境、部分原料炭化等问题.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
①根据表中数据,下列C (填字母)为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为乙醇脱水生成乙醚.
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:(1)欲提高乙酸的转化率,可采取的措施有:增大乙醇浓度、移去生成物等.
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为原料来不及反应就被蒸出、温度过高发生副反应等.
(3)此反应以浓硫酸为催化剂,可能会造成产生大量酸性废液污染环境、部分原料炭化等问题.
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用.实验数据如下表所示(乙酸和乙醇以等物质的量混合).
| 同一反应时间 | 同一反应温度 | |||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* | |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 | |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 | |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 | |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 | |
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应温度达到120℃时,反应选择性降低的原因可能为乙醇脱水生成乙醚.
17.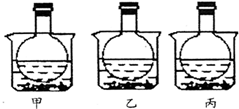 如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
 如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )| A. | 甲烧瓶中气体颜色变浅 | B. | 乙烧瓶中气体颜色变深 | ||
| C. | 丙烧瓶中气体压强明显增大 | D. | 上述三种说法都不正确 |
4. 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g) 分子中化学键断裂时需吸收的能量为299kJ.
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的表达式为:$\frac{0.108×0.108}{0.78{4}^{2}}$.
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
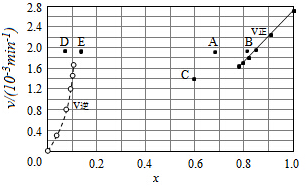
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g) 分子中化学键断裂时需吸收的能量为299kJ.
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)
14.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡时,4 v正(O2)=5 v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡时,若减小容器体积,则NH3的转化率会增大 |
1.下列物质的名称、俗名与化学式完全对应的是( )
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钠 烧碱 NaOH | D. | 氢氧化钙 熟石灰 CaO |
18. 某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)用标准溶液润洗滴定管2-3次
(B)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取10.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(F)在锥形瓶下垫一张白纸,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
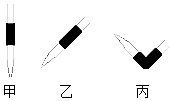
(1)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(2)E操作中在锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况
(3)实验中,用左手控制活塞(填仪器及名称),眼睛应注视锥形瓶内溶液颜色的变化,直至滴定终点.
(4)几次滴定消耗NaOH溶液的体积如表:
则该盐酸溶液的准确浓度为0.8000mol/L.(保留小数点后4位)
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:CD (错选全扣)
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.碱式滴定管滴定前无气泡,滴定后尖嘴部分有气泡.
 某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)用标准溶液润洗滴定管2-3次
(B)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取10.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(F)在锥形瓶下垫一张白纸,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(2)E操作中在锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况
(3)实验中,用左手控制活塞(填仪器及名称),眼睛应注视锥形瓶内溶液颜色的变化,直至滴定终点.
(4)几次滴定消耗NaOH溶液的体积如表:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:CD (错选全扣)
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.碱式滴定管滴定前无气泡,滴定后尖嘴部分有气泡.
19.等质量的CO和N2,下列叙述不正确的是( )
| A. | 密度一定相同 | B. | 分子数一定相同 | ||
| C. | 原子数一定相同 | D. | 物质的量一定相同 |